- Цитрат натрия
- Показания к применению
- Возможные аналоги (заменители)
- Действующее вещество, группа
- Лекарственная форма
- Противопоказания
- Как применять: дозировка и курс лечения
- Фармакологическое действие
- Побочные действия
- Особые указания
- Взаимодействие
- Вопросы, ответы, отзывы по препарату Цитрат натрия
- Натрия цитрат
- Натрия цитрат в составе оральных регидратационных солей
- Натрия цитрат — антацид
- Натрия цитрат в составе слабительных
- Натрия цитрат в составе гемоконсервантов
- Натрия цитрат в составе средства для лечения мочекаменной болезни
- Natrii citras pro injectionibus. Натрия цитрат для инъекций
- Natrii oxybutyras. Натрия оксибутират. Ho-ch2-ch2-ch2-cooNa
- Lithii oxybutyras. Ho-ch2-ch2-ch2-cooLi
- Препараты алифатических аминокислот.
- Натрий цитрат (лимоннокислый) — пищевая добавка и компонент фармацевтических средств
Цитрат натрия
Показания к применению
Консервирование крови, симптоматическое лечение цистита.
Возможные аналоги (заменители)
Действующее вещество, группа
Лекарственная форма
Противопоказания
Гиперчувствительность к компонентам препарата.
C осторожностью. Заболевания сердца, почек, артериальная гипертензия, сахарный диабет, беременность, период лактации, гипосолевая диета.
Как применять: дозировка и курс лечения
Внутрь, по 1 пакету препарата (предварительно растворив в 1 стакане воды) 3 раза в день, в течение 2 дней.
Фармакологическое действие
Антикоагулянтное средство. Применение препарата снижает свертываемость крови, повышает щелочные резервы крови, защелачивает мочу. Связывает Ca2+ (IV плазменный фактор свертывания крови) и делает невозможной гемокоагуляцию (in vitro). Повышает концентрацию Na+ в организме.
Изменение реакции мочи под воздействием препарата с кислой на щелочную приводит к исчезновению дизурических явлений.
Побочные действия
Аллергические реакции на компоненты препарата.
Снижение аппетита, тошнота, рвота, боль в животе, повышение АД.
Особые указания
Не следует часто повторять курс лечения препаратом. В случае сохранения симптомов цистита необходимо верифицировать диагноз. У мужчин и детей цистит часто имеет бактериальную природу, поэтому не рекомендуется назначать лечение препаратом этим пациентам.
Взаимодействие
Значимого лекарственного взаимодействия при лечении совместно с другими препаратами не выявлено.
Вопросы, ответы, отзывы по препарату Цитрат натрия
Активные компоненты:
Ново-Пассита экстракт жидкий (получаемый из корневищ с корнями валерианы лекарственной, травы мелиссы лекарственной, травы зверобоя продырявленного, листьев и цветков боярышника однопестичного или колючего, травы пассифлоры инкарнатной (страстоцвета), соплодий хмеля обыкновенного, цветков бузины черной) 7,75 г; Гвайфенезин — 4,00 г в 100 мл раствора
Вспомогательные вещества:
натрия цикламат, камедь ксантановая, сахарный сироп инвертный, натрия бензоат, натрия сахарин моногидрат, этанол 96%, аромат апельсиновый, натрия цитрат дигидрат, мальтодекстрин, пропиленгликоль, вода очищенная.
Приведенная информация предназначена для медицинских и фармацевтических специалистов. Наиболее точные сведения о препарате содержатся в инструкции, прилагаемой к упаковке производителем. Никакая информация, размещенная на этой или любой другой странице нашего сайта не может служить заменой личного обращения к специалисту.
Источник
Натрия цитрат
Натрия цитрат или натрий лимоннокислый (англ. sodium citrate) — общее название ряда натриевых солей лимонной кислоты.
Цитраты натрия, применяемые в фармацевтике и пищевой промышленности
Натрия цитрат в медицине
Натрия цитрат, как одно из действующих веществ в составе комплексных лекарственных препаратов, используется в разных областях медицины. По фармакологическому указателю натрия цитрат входит в группы: «Антикоагулянты», «Регуляторы водно-электролитного баланса и КЩС» и «Средства, препятствующие образованию и способствующие растворению конкрементов». В разделе АТХ «B05 Плазмозамещающие и перфузионные растворы» натрия цитрату присвоен код АТХ B05CB02.
Натрия цитрат в качестве вспомогательного вещества используется во многих лекарствах, в частности, в Релтцере, Нанипрусе, Неовире, Альдецине и другие.
Натрия цитрат в составе оральных регидратационных солей
Натрия цитрат включают в состав растворов оральных регидратационных солей (ОРС), применяемых для возмещения потери жидкости и электролитов в организме при обильной диарее, многократной рвоте, экссудации с обширных раневых и ожоговых поверхностей, выделениях через дренажи и свищи, частых приемах слабительных средств, а также для коррекции кислотно-щелочной среды в организме пациента. В России зарегистрированы (были зарегистрированы) как лекарственные препараты следующие оральные регидратационные соли с комплексным действующим веществом натрия цитрат + калия хлорид + натрия хлорид + декстроза: Гидровит, Гидровит форте, Регидрон, Цитраглюкосолан. Содержимое солей и глюкозы в этих препаратах, г на 1 л раствора следующие: *)
| Ингредиент | Содержимое глюкозы и солей в ОРС, зарегистрированных в РФ в качестве лекарств, г на 1 л раствора *) | |||||
| Регидрон 1 пакетик | Гидровит 5 пак. | Гидровит форте 5 пак. | Цитраглюкосолан 1 пак 24,9 г, 2 пак 12,45 г (или пак 11,95 г) **) | Тригидрон | ||
| глюкоза (декстроза) безводная | 13,5 | 10 | 17,8 | 20 | 15 | 5 |
| калия хлорид | 1,5 | 2,5 | 1,5 | 1,5 | 3,5 | 1,25 |
| натрия хлорид | 2,6 | 3,5 | 2,35 | 2,8 | 3,5 | 1,75 |
| натрия цитрат | 2,9 | 2,9 | 2,65 | 2,95 | 2,9 | 1,75 |
Примечания.
*) разные лекарственные препараты выпускают в пакетиках, предназначенных для приготовления разного объема раствора оральных регидратационных солей; в таблице, рядом с названием препарата указано число пакетиков, необходимых для приготовления 1 литра раствора, а ниже приведено количество глюкозы или солей в указанном количестве пакетиков и требуемое для приготовления 1 л раствора ОРС
**) Цитраглюкосолан выпускается (выпускался) разными российскими производителями, состав, вес пакетиков может отличаться от указанных в таблице
Натрия цитрат — антацид
Натрия цитрат является антацидом системного действия (Конорев М.Р.). Он может использоваться в целях профилактики регургитации и аспирации при проведении общей анестезии путем применения парентеральных в составе средств премедикации у больных в неотложной хирургии. 3% цитрат натрия в дозе 30 мл принимается перорально после традиционной премедикации за 30-60 минут до начала операции. Максимальный антацидный эффект наступает через 20 минут после его введения (Левичев Э.А., Недашковский Э.В.).
На сайте www.gastroscan.ru в каталоге литературы имеется раздел «Антациды», содержащий статьи, посвященные терапии заболеваний органов ЖКТ антацидами.
Натрия цитрат в составе слабительных

Слабительное средство — одноразовая микроклизма Микролакс имеет комплексное действующее вещество: натрия цитрат + натрия лаурилсульфоацетат + сорбитол.
На сайте gastroscan.ru в каталоге литературы имеются разделы «Слабительные» и «Запоры и диарея», содержащие профессиональные медицинские статьи, касающиеся слабительных препаратов и их применения при запоре.
Натрия цитрат в составе гемоконсервантов
- ЦФГ, раствор, применяемый для консервации крови. Действующие вещества: натрия цитрат пентасесквигидрат + натрия дигидрофосфата дигидрат + декстрозы моногидрат + лимонной кислоты моногидрат
- Глюгицир, Антикоагулянт Цитрат декстроза. Действующие вещества: натрия цитрат + декстроза
- Фаглюцид, Циглюфад, ЦФДА-1. Действующие вещества: натрия цитрат + аденин + декстроза + лимонная кислота + натрия дигидрофосфат
Натрия цитрат в составе средства для лечения мочекаменной болезни
Препарат Блемарен, действующие вещества: натрия цитрат + калия гидрокарбонат + лимонная кислота, применяют для лечения мочекаменной болезни, как нефролитолитическое средство, ощелачивающее мочу.
У соединений натрия цитрата имеются противопоказания, побочные действия и особенности применения, необходима консультация со специалистом.
Цитрат натрия — пищевая добавка
Пищевые цитраты натрия подразделяются на:
- Е331 (i) — цитрат натрия 1-замещённый
- Е331 (ii) — цитрат натрия 2-замещённый
- Е331 (iii) — цитрат натрия 3-замещённый
В пищевой промышленности натрия цитрата используется как вкусовая добавка, усилитель вкуса, регулятор кислотности, стабилизатор, комплексообразователь. Его часто включают в состав газированных напитков для придания им вкуса лимона или лайма, в частности, он определяет вкус таких напитков, как Спрайт, Red Bull, Фреш Лимон и других.
Источник
Natrii citras pro injectionibus. Натрия цитрат для инъекций
Описание: белые кристаллы или кристаллический порошок без запаха, выветривающиеся на воздухе
Растворимость: легко – в воде, практически нерастворим в спирте
Получение: взаимодействие лимонной кислоты с карбонатом Nа. Полученную соль перекристаллизовывают из спирта.
Подлинность: ИКС, реакция А на цитраты (с хлоридом кальция):
2 


Осадок растворим в HCl.
1. Реакция Б на цитраты: при нагревании цитрата с уксусным ангидридом через 20-40 секунд развивается карминово-красное окрашивание
2. Реакция Штаре:


Выпадает белый кристаллический осадок.
3. С реактивом Денеже: свежеприготовленный раствор основного сульфата ртути.

Чистота: раствор должен быть прозрачным и бесцветным; рН 7,8-8,3; недопустимы As (III), допустимы общие.
Специфические: тартраты – насыщенный раствор + ацетатный буфер – раствор должен быть прозрачен.
Оксалаты: навеску растворяют в воде, прибавляют HCl, спирт и CaCl2, оставляют на час, раствор должен остаться прозрачным.
Потеря в массе при выслушивании – 25-28%, микробиологическая чистота
Количественное определение: неводное титрование
2. натрия цитрат + 3CH3COOH 3Na + + 3CH3COO — + лимонная кислота
3. CH3COO — + CH3COOH2 + 2CH3COOH
ГФX: ионобменная хроматография
Цитарт натрия + [катионит]Н + [катионит]3Na + + лимонная кислота.
Титруют NaOH с фенолфталеином. f=1/3.
натрия цитрат + 3HCl 
2. Обратная аргентометрия:
натрия цитрат + 3AgNO3 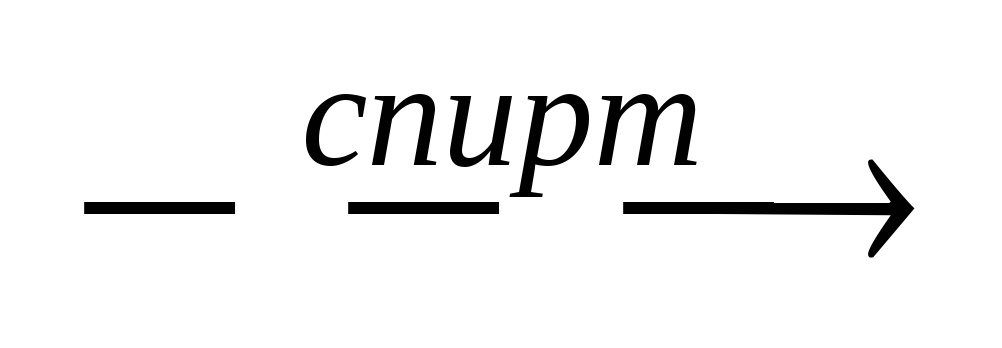
Избыток нитрата серебра оттитровывают роданометрически (NH4SCN) .f=1/3
3. Образование комплекса с медью – прямая куприметрия (CuSO4) с мурексидом.
Хранение: сухое прохладное место
Применение: консервант препаратов крови.
Natrii oxybutyras. Натрия оксибутират. Ho-ch2-ch2-ch2-cooNa
Описание: белый с желтоватым оттенком гигроскопичный порошок. ЛР в воде, Р в спирте, ПНР в эфире, хлороформе.
Получение: из -бутиролактона (специфическая примесь)
Подлинность: ИКС, Б – на Na; лактона – гидроксамовая проба
Количественное определение: неводное титрование f=1; прямая ацидиметрия f=1.
Хранение: список Б, в сухом, защищенном от света месте.
Применение: снотворное, неингаляционный наркоз, порошки, ампулы, сиропы, концентрат (66,7%).
Lithii oxybutyras. Ho-ch2-ch2-ch2-cooLi
Подлинность: окрашивает пламя в фиолетовый цвет, рефрактометрия.
Количественное определение: неводное титрование.
Хранение: список Б
Применение: в психиатрии.
Препараты алифатических аминокислот.
Аминокислоты – соединения природного происхождения, являются строительным материалом для конструкции природных белков и пептидов. Характерная особенность – наличие амино- и карбоксилоной групп. Природные аминокислоты – бесцветные, белые и желтоватого оттенка кристаллические субстанции, хорошо растворимые в воде, хуже в органических растворителях. Некоторые имеют запах.
1. Природные объекты – мясо, молоко, кожа. Получают гидролизом.
2. Синтетические – более 70% всех получаемых аминокислот. Синтезируют на основе галогенкарбоновых кислот или амномалонового эфира.
Тесно связано с физическими свойствами ассиметрического атома углерода (оптическая активность).
1. -COOH, -NH2 придают свойства амфотерности. АК взаимодействуют и с кислотами и со щелочами, способны образовывать комплексы с медью, серой, цинком, свинцом и др.
2. COO — , NH3 + (образование цветтер-иона).
3. Мало и медленно, но растворимы в воде, лучше в горячей, нерастворимы или плохо растворимы в органических растворителях
Источник
Натрий цитрат (лимоннокислый) — пищевая добавка и компонент фармацевтических средств
Натрий лимоннокислый — органическое вещество, 
Цитрат натрия — производное лимонной кислоты. Эта кислота трехосновная, поэтому цитрат может быть:
- однозамещенным с формулой C6H7O7Na;
- двузамещенным C6H6O7Na2;
- трехзамещенным C6H5O7Na3.
Все три вида вещества являются пищевыми добавками Е331, различаются индексами i, ii, iii. Добавка разрешена во всех странах Евросоюза и РФ.
Мелкокристаллический порошок белого или слегка желтоватого цвета. Без запаха, кисло-соленого вкуса. Водорастворим, не растворяется в этиловом спирте. Образует кристаллогидраты с 1, 1.5, 2, 5.5 молекулами воды. Не горит, не взрывается, не ядовит.
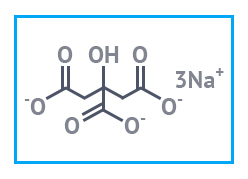 | 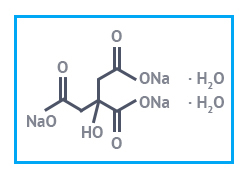 |
| Натрий цитрат (Натрий лимоннокислый) | Натрий лимоннокислый 3-зам.(дигидрат) «ч» пищевой Е331 |
Участвует в метаболизме человека, регулирует водно-электролитный, кислотно-щелочной баланс. Не накапливается в организме, легко выводится. Считается безвредным, до сих пор не зафиксировано ни одного случая отравления соединением. Относится к веществам 3-го класса опасности: может вызывать раздражение слизистых верхних дыхательных путей при попадании в них мелкодисперсионной пыли. Прием внутрь большой дозы может привести к головокружению, рвоте, резкому повышению давления, диарее, боли в желудке. Передозировка возможна только при неправильном приеме лекарственных средств, в пище содержание добавки слишком мало.
Лимоннокислый натрий можно перевозить любым транспортом. Для его хранения подходят сухие склады с влажностью воздуха не более 70%. Упаковка — герметично заваренные полиэтиленовые мешки из пленки, разрешенной к контакту с пищевыми продуктами. Пластиковый мешок потом вставляют в бумажный или тканевый, или в контейнер из гофрокартона.
- Большая часть производимого реактива
используется в пищепроме в качестве консерванта, эмульгатора, регулятора уровня кислотности, стабилизатора, антиоксиданта, усилителя вкуса. Также, в чистом виде, как специя для придания пище более острого и пряного вкуса. Применяется при производстве напитков; пастеризованного, консервированного и сухого молока; соусов, выпечки, колбас и плавленого сыра; желе, мармелада, йогуртов, карамели, мороженого; консервов, маргаринов и многого другого. Разрешен для детского питания.
- В фармацевтике — при выпуске лекарств от инфекций мочеполовой системы, изжоги, обезвоживания; быстрорастворимых таблетированных форм; слабительного. Способствует усилению действия аскорбиновой кислоты.
- В медицине — антикоагулянт при взятии донорской крови, при переливании крови. Применяется в процессе проведения некоторых анализов крови. Используется для сохранения белковых препаратов.
- В косметической индустрии — для регулирования уровня кислотности и пенообразования в шампунях, лосьонах, тониках, мыле.
- В аналитической химии — для обнаружения ионов аммония.
- В ветеринарии — входит в состав среды для размораживания спермы животных.
- Как буферный раствор с постоянным уровнем рН.
- В кофе-машинах для контроля уровня кислотности.
- Добавляется в средства для очистки стекол.
- Для быстрого избавления от похмельного синдрома.
Источник





 используется в пищепроме в качестве консерванта, эмульгатора, регулятора уровня кислотности, стабилизатора, антиоксиданта, усилителя вкуса. Также, в чистом виде, как специя для придания пище более острого и пряного вкуса. Применяется при производстве напитков; пастеризованного, консервированного и сухого молока; соусов, выпечки, колбас и плавленого сыра; желе, мармелада, йогуртов, карамели, мороженого; консервов, маргаринов и многого другого. Разрешен для детского питания.
используется в пищепроме в качестве консерванта, эмульгатора, регулятора уровня кислотности, стабилизатора, антиоксиданта, усилителя вкуса. Также, в чистом виде, как специя для придания пище более острого и пряного вкуса. Применяется при производстве напитков; пастеризованного, консервированного и сухого молока; соусов, выпечки, колбас и плавленого сыра; желе, мармелада, йогуртов, карамели, мороженого; консервов, маргаринов и многого другого. Разрешен для детского питания.

