Приказ № 4н о рецептурных бланках 2020-го года: подробный разбор
Обзор вебинара о новых правилах отпуска рецептурных препаратов в 2020 году и порядке назначения и оформления бланков медицинских рецептов — изучаем изменения наглядно
19 апреля на нашем сайте состоялся вебинар, посвященный вступлению в силу новых правил выписывания лекарственных средств. Для тех, кто пропустил трансляцию, мы подготовили обзор главных изменений, которые внес новый приказ в порядок взаимодействия врачей и фармацевтов. Лектор вебинара — к. ф. н., доцент кафедры управления и экономики фармации Северо-Западного государственного медицинского университета (СЗГМУ) им. И. И. Мечникова (г. Санкт-Петербург) Лариса Гарбузова. Она рассказала о нормах приказа Минздрава РФ от 14.01.2019 № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения», вступившего в силу 7 апреля 2019 года.
Приказ
Начнем с самого главного: новый приказ № 4н не несет в себе глобальных изменений по сравнению с приказом Минздрава 1175 н и принципиально не меняет привычную схему взаимодействия врача и фармацевта (провизора). Основные новшества коснулись только порядка назначения лекарственных препаратов, формы бланков рецептов на лекарства и порядка их оформления в 2020 году.
Назначение
Начнем с назначения ЛС. Препараты, как и раньше, назначаются по МНН, а при его отсутствии — по группировочному наименованию. Или же по торговому наименованию, если первые два отсутствуют.
Здесь стоит обратить внимание на то, что информация в Государственном реестре лекарственных средств постоянно обновляется, и некоторые препараты (например, отпуск кодеинсодержащих препаратов) недавно лишились группировочных наименований в регистрационных досье. Таким образом, выписка их по торговому наименованию не является нарушением, даже если на рецепте нет отметки «По решению врачебной комиссии». Поэтому необходимо внимательно проверять то, какие данные о препарате содержатся в ГРЛС.
Изменения приказа коснулись назначения лекарственных препаратов в стационарах. Теперь на них так же распространяется правило назначения только по МНН или группировочному наименованию. Назначить препарат по торговому наименованию в стационаре можно только при их отсутствии. Ранее, напомним, в приказе № 1175н лекарственные препараты в стационарах можно было назначать сразу по ТН.
Еще теперь при выписке из стационара пациенту назначаются ЛС (в том числе наркотические, психотропные, сильнодействующие) с оформлением рецепта или эти препараты выдаются одновременно с выпиской из истории болезни на срок приема до 5 дней. Раньше лекарства просто выдавали пациенту, а оформление рецепта разрешалось только в «отдельных случаях».
Бланки
Главное — отменен рецептурный бланк № 148–1/у-06 (л). Все рецепты препаратов, отпускаемые бесплатно или со скидкой, с 2020 года выписываются на бланке нового образца рецепта формы № 148–1/у-04 (л).
Списки препаратов для каждого бланка остались без изменений.
Напомним, что на рецептурных бланках формы № 107/у-НП в 2020 г. выписываются рецепты на: наркотические средства и психотропные вещества списка II, кроме трансдермальных терапевтических систем и лекарств, содержащих наркотические средства в сочетании с антагонистом опиоидных рецепторов.
На рецептурном бланке формы № 148–1/у-88 выписываются:
— наркотические и психотропные ЛП Списка II в виде ТДТС-ЛП, содержащие НС в сочетании с антагонистом опиоидных рецепторов;
— психотропные ЛП Списка III;
— ЛП, обладающие анаболической активностью, относящиеся по АТХ к анаболическим стероидам (код А14А);
— ЛП, указанные в пункте 5 Приказа Минздрава 562 н от 17.05.2012;
— ЛП индивидуального изготовления, содержащие НС или ПВ Списка II и другие фармакологически активные вещества;
— иные ЛП, подлежащие ПКУ.
На бланке рецепта формы № 107–1/у выписываются все остальные препараты и ЛС, указанные в п. 4 приказа 562 н Министерства здравоохранения.
Форма рецептурных бланков на 2020 год
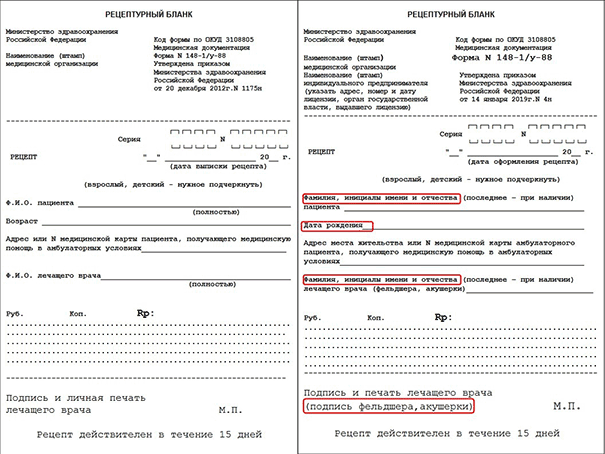
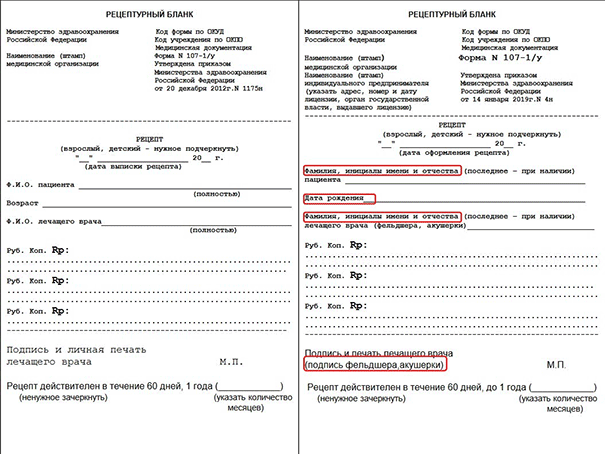
Очевидно, что на бланках изменилось наименование приказа, которым они утверждены. Теперь вверху каждого рецепта должно быть указание на приказ Министерства здравоохранения Российской Федерации от 14 января 2019 г. № 4н, а не на 1175н приказ Минздрава, как раньше. Это не касается рецептурного бланка формы N 107/у-НП, поскольку его форма утверждена приказом минздрава 54 н от 01.08.2012 г.
Также поменялись реквизиты. Теперь не надо указывать полностью фамилию, имя и отчество пациента, достаточно только фамилии и инициалов. Это же касается и ФИО врача, назначающего препарат. Кроме того, теперь в рецептах указывается дата рождения, а не возраст больного.
Для наглядности ниже мы приводим сравнение старых и новых образцов бланков, где изменения выделены красным цветом.
Сразу напомним про сроки действия старых рецептурных бланков и старого порядка их заполнения. Если рецепт оформлен до 7 апреля 2019 (до вступления в силу приказа № 4н), то он должен быть выписан в соответствии с приказом МЗ РФ 1175 н. В начале апреля Минздрав выпустил информационное письмо, в котором допустил возможность использования старых бланков до конца 2019 года. Но если рецепт оформлен после 7 апреля, то все реквизиты должны быть заполнены в соответствии с приказом № 4н, даже если бланк старый. Это значит, что вместо возраста надо указывать дату рождения, а в поле «ФИО» писать инициалы.
На рецептах больше не используется формулировка «пациент с хроническим заболеванием». Теперь это «пациент с заболеванием, требующим длительного курса лечения». На рецептах в этом случае ставится отметка «по специальному назначению». Срок действия таких рецептов на лекарства в России составляет до 1 года, при этом на рецепте нужно указать количество месяцев и периодичность отпуска.
Дозировка в рецептах выписывается согласно инструкции по применению препарата. Например, это значит, что количество вещества можно указывать в миллиграммах. Требование об обязательном оформлении твердых и сыпучих фармсубстанций в граммах (миллилитрах/каплях для жидких препаратов) осталось только для выписки препаратов индивидуального изготовления.
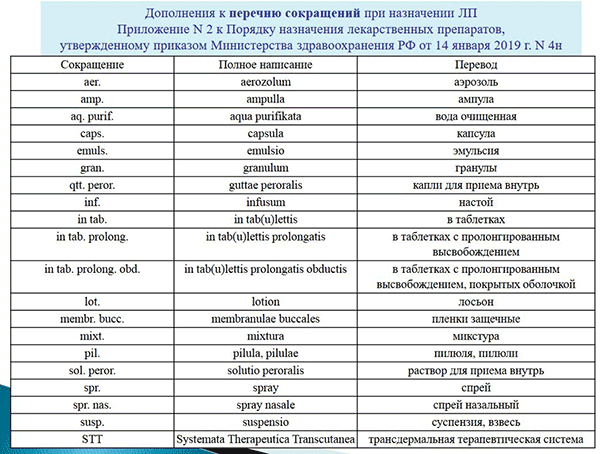
Также расширен список используемых латинских сокращений. В основном за счет введения «новых» (не указанных ранее) лекарственных форм. Например, наконец‑то дистиллированная вода стала простой «водой очищенной». Кроме этого, лекарственную форму в таблетках теперь следует писать как «in tab», а не «in tabl».
Нормы отпуска
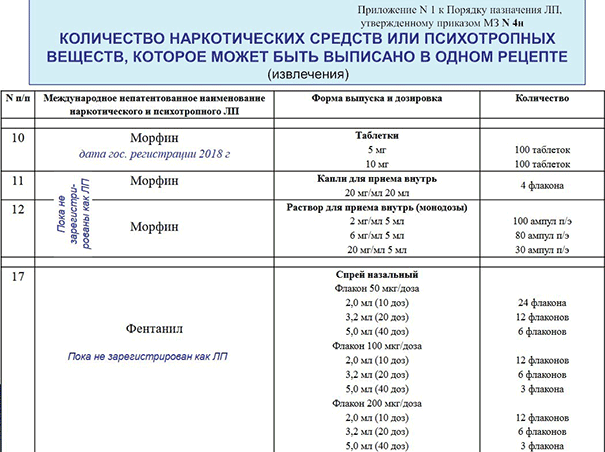
Нормы отпуска содержались и в прошлом приказе с правилами выписывания рецептов. В № 4н осталось Приложение № 1, которое устанавливает максимальные количества наркотических средств или психотропных веществ, которые нельзя превышать по правилам выписки таких лекарственных средств на одном рецепте. Сама таблица в приложении немного изменилась. Теперь в нее добавлены морфин и фентанил в новых лекарственных формах.
Важным изменением в порядке выписывания лекарственных средств является отмена бывшего Приложения № 2 с «рекомендованным количеством». Сейчас больше нет норм отпуска на комбинированные препараты с кодеином и другим ЛС, которые подлежат ПКУ. Таким образом, эти и другие ЛС (не указанные в Приложении № 1) следует отпускать в тех количествах, в которых они выписаны.
При этом, в приказе остался пункт 25, который полностью повторяет пункт 22 из приказа 1175н МЗ РФ, что рецепты на определенные препараты могут выписываться на курс лечения до 60 дней со специальным оформлением. Однако, в предыдущем приказе указывалось, что в этом случае можно превысить количества, указанные в Приложении № 2. Но теперь нет ссылки на Приложение № 2 и, скорее всего, это значит, речь идет о Приложении № 1.
Кроме этого, в 2020 году на одном рецептурном бланке можно выписывать только одно наименование ЛС, не подлежащего ПКУ и относящегося к:
— антипсихотическим средствам (код N05A по АТХ);
— анксиолитикам (код N05Bпо АТХ);
— снотворным и седативным средствам (код N05C по АТХ);
— и антидепрессантам (код N06Aпо АТХ).
Таким образом решается проблема с исполнением п. 14 правил отпуска (приказ № 403н). Ведь такие рецепты необходимо хранить в аптеке в течение трех месяцев, но раньше на рецепте можно было выписать до трех наименований таких ЛС. И если пациент приобретал только одно, то рецепт надо было оставить в аптеке, а для отпуска двух других препаратов требовалось оформление нового бланка.
Экспертиза
Алгоритм работы с рецептами в соответствии с новым приказом можно изобразить в виде простой схемы:
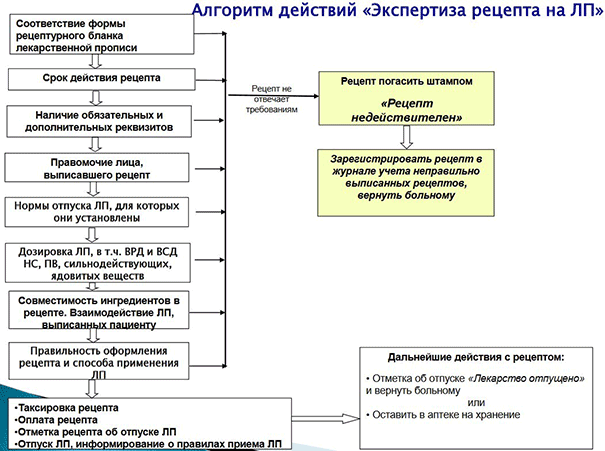
Всё также важно проверять сроки действия рецептов — они не изменились в сравнении с приказом № 1175н. Также необходимо внимательно смотреть на обязательные для всех бланков реквизиты. Помните, что имя врача может быть заполнено не только от руки, но и штампом.
По мнению Ларисы Гарбузовой, скорее всего, в первое время после вступления в силу нового приказа будет очень много ошибок в заполнении поля «возраст» и в указании ФИО полностью, без инициалов. Особенно если рецепт будет выписан на старом бланке. Является ли это нарушением, запрещающим отпуск препарата? К сожалению, четкого ответа на этот вопрос нет. Равно как нет и практики привлечения за это к ответственности, поскольку приказ вступил в силу совсем недавно.
Стандартная операционная процедура
Не стоит забывать, что для проведения экспертизы рецептов и правильного отпуска в аптеке необходимо разработать СОП для этих процедур. Пример того, что может быть указано в документе, мы приводим на иллюстрации ниже.

И в заключение нужно сказать, что утверждение нового порядка отпуска неминуемо вызовет изменение других нормативных документов, регламентирующих правила выписывания и оформление рецептов, в будущем. Например, порядка отпуска препаратов (приказ № 403н) — хотя бы потому, что в нем до сих пор присутствует ссылка на старый приказ. Также в приказе № 403н нет порядка отпуска лекарственных средств при помощи электронных рецептов.
Кроме этого, и сам приказ № 4н далеко не идеальный. Всё еще остаются спорные моменты, такие как: присутствие пункта 25 или вопрос о том, является ли нарушением указание на старом бланке возраста вместо даты рождения. Поэтому будем надеяться, что уже в ближайшем будущем Минздрав выпустит письмо с дополнительными разъяснениями или внесет поправки в сам приказ.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Источник
Задачи к экзамену с решением (фармацевтическая технология)
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
№ 1.
1. Recipe:
Atropini sulfatis 0,0003
Papaverini hydrochloridi 0,04
Anaesthеsini 0,15
Natrii sulfatis 0,2
Misce fiat pulvis.
Da tales doses № 30.
Signa:
По 1 порошку 3 раза в день.
2. Свойства ингредиентов.
Atropini sulfas – (ГФ Х, ст.76) – белый кристаллический или зернистый порошок без запаха, сп. «А».
Papaverini hydrochloridum – (ГФ Х, ст. 503) – белый кристаллический порошок без запаха, слегка горьковатого вкуса, список «Б».
Anaesthesinum – (ГФ Х, ст. 55) – белый кристаллический порошок без запаха, слабо горького вкуса. Вызывает на языке чувство онемения, список “Б”.
Natrii sulfas – (ГФ Х, ст. 439) – бесцветные, прозрачные, выветривающиеся на воздухе кристаллы горько-соленого вкуса.
3. Ингредиенты:
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный дозированный порошок для внутреннего применения, выписанный распределительным способом, с веществом списка «А»– атропина сульфатом, выписанном в малом количестве (менее 0,05г) и веществами сп. Б – папаверина гидрохлоридом и анестезином, а также с крупнокристаллическим веществом общего списка – натрия сульфатом. По дисперсологической классификации – свободная всесторонне дисперсная система с твердой дисперсной фазой и газообразной дисперсионной средой (воздух).
5. Проверка доз и норм одноразового отпуска.
– Атропина сульфат – сп. «А»
В.р.д. – 0,001 р.д. – 0,0003
В.с.д. – 0,003 с.д. – 0,0009
Дозы не завышены.
– Папаверина гидрохлорида – сп. «Б»
В.р.д. – 0,2 р.д. – 0,04
В.с.д. – 0,6 с.д. – 0,12
Дозы не завышены
– Анестезина – сп. «Б»
В.р.д. – 0,5 р.д. – 0,15
В.с.д. – 1,5 с.д. – 0,45
Дозы не завышены
Рецепт выписан правильно, оформлен штампом, печатью ЛПУ «Для рецептов», личной печатью и подписью врача. Атропина сульфат подчеркивают в рецепте красным карандашом.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ XI изд. «Порошки». Паспорт письменного контроля оформляется в соответствии с приказом МЗ РФ № 214 от 16.07.97.
Учитывая общую массу порошков выбирают ступку № 5. На ручных весах ВР-10 отвешивают 6,0 г натрия сульфата, помещают в ступку (соотношение 0,9: 6,0 не превышает 1: 20) и измельчают первым, потому что это крупнокристаллическое вещество и его потери в порах ступки наименьшие.
Соблюдая правила работы с лекарственными веществами сп. «А», провизор-технолог в присутствии фармацевта отвешивает 0,9 г тритурации атропина сульфата (1: 100) на отдельных ручных весах ВР-1, которые хранят в шкафу «А». Об этом делается отметка в паспорте письменного контроля и на оборотной стороне рецепта. Тритурацию помещают в ступку с измельченным натрия сульфатом, порошки тщательно смешивают. Затем на ручных весах ВР-5 отвешивают папаверина гидрохлорида 1,2 г и анестезина 4,5 г, измельчают и смешивают до получения однородного порошка. Развешивают на ручных весах ВР-1 по 0,42 на 30 доз.
8. Упаковка и оформление.
Порошки упаковывают в парафинированные или вощеные капсулы (атропина сульфат и натрия сульфат – выветривающиеся на воздухе вещества). Складывают по 5 порошков и помещают в бумажный пакет, который опечатывают сургучной печатью. Лекарственную форму оформляют этикеткой «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены; предупредительными надписями: «Обращаться с осторожностью», «Беречь от детей», выписывают сигнатуру; наклеивают номер рецепта и хранят в отдельном запирающемся шкафу до отпуска больному.
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК, сигнатура и номер лекарственной формы соответствуют друг другу. Расчеты верны. В рецепте красным карандашом подчеркнуто наименование вещества сп. «А». На паспорте письменного контроля и на обратной стороне рецепта указано количество вещества сп. «А» и подписи провизора-технолога и фармацевта.
– Правильность упаковки и оформления. Порошки упакованы в вощеные капсулы с учетом физико-химических свойств ингредиентов, при переворачивании не просыпаются, сложены по 5 штук в бумажный пакет. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97.
– Органолептический контроль. Порошки белого цвета, горько-солоноватого вкуса, без запаха.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе отдельных порошков. Средняя масса и отклонения в массе порошков находятся в пределах ±5% (0,42± 0,02) (приказ МЗ РФ № 305 от 16.10 97г.)
10. Применение.
В качестве обезболивающего и спазмолитического средства.
№ 2.
1. Recipe:
Extracti Belladonnae 0,01
Bismuthi subnitratis
Natrii hydrocarbonatis aa 0,2
Misce ut fiat pulvis.
Da tales doses № 10.
Signa:
По 1 порошку 3 раза в день.
2. Свойства ингредиентов.
Extractum Belladonnae spissum – (ГФ Х, ст. 255) густая масса темно-бурого цвета, своеобразного запаха, сп. Б.
Bismuthi subnitras – (ГФ Х, ст. 107) белый аморфный или мелкокристаллический порошок.
Natrii hydrocarbonas – (ГФ Х, ст. 430) белый кристаллический порошок, без запаха, солено-щелочного вкуса, устойчив в сухом воздухе, медленно разлагается во влажном.
3. Ингредиенты:
Совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный дозированный порошок для внутреннего применения, выписанный распределительным способом с веществом сп. Б – экстрактом красавки. По дисперсологической классификации – свободная всесторонне дисперсная система с твердой дисперсной фазой и газообразной дисперсионной средой (воздух).
5. Проверка доз и норм одноразового отпуска.
Экстракт красавки густой
В.р.д. – 0,05 р.д. – 0,01
В.с.д. – 0,15 с.д. – 0,03 (0,01 ? 3 = 0,03)
Дозы не завышены
Наркотических и приравненных к ним веществ в прописи нет.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ XI изд. «Порошки». Паспорт письменного контроля оформляется в соответствии с приказом МЗ РФ № 214 от 16.07.97.
Для изготовления 10 порошков необходимо измельчить и смешать 4,2 г порошков, поэтому выбирают ступку № 4. В ступке растирают 2,0 г натрия гидрокарбоната (меньше теряется в порах ступки по сравнению с висмута нитратом основным), затем добавляют 0,2 г экстракта красавки сухого (1: 2) (соотношение смешиваемых ингредиентов не превышает 1: 20), а затем к полученной смеси добавляют 2,0 г висмута нитрата основного, измельчают, смешивают. Контролируют однородность порошка визуально. Порошки развешивают по 0,42 на весах ВР-1 на дозы и упаковывают.
8. Упаковка и оформление.
Порошки упаковывают в вощеные капсулы (экстракт красавки гигроскопичен, натрия гидрокарбонат – неустойчив во влажном воздухе, разлагается). Складывают по 5 порошков и помещают в бумажный пакет. Лекарственную форму оформляют этикеткой «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены; предупредительной надписью: «Беречь от детей»; наклеивают номер рецепта.
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют друг другу. Расчеты верны.
– Правильность упаковки и оформления. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97. Отдельные дозы аккуратно завернуты в вощеные капсулы, сложены по 5, уложены в пакет.
– Органолептический контроль. Порошки буроватого цвета, вкус солоноватый, вяжущий, со слабым своеобразным запахом.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе отдельных порошков. Средняя масса и отклонения в массе порошков находятся в пределах ±5% (0,42±0,02) (приказ МЗ РФ № 305 от 16.10 97г.)
10. Применение.
Вяжущее, антацидное, спазмолитическое средство.
№ 3.
1. Recipe:
Acidi ascorbinici 0,1
Glucosi 0,2
Thiamini bromidi 0,05
Misce ut fiat pulvis.
Da tales doses № 6.
Signa:
По 1 порошку 3 раза в день.
2. Свойства ингредиентов.
Acidum ascorbinicum – (ГФ Х, ст. 6) белый кристаллический порошок без запаха, кислого вкуса.
Glucosum – (ГФ Х, ст. 311) бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладкого вкуса.
Thiamini bromidum – (ГФ Х, ст. 673) белый со слегка желтоватым оттенком порошок со слабым характерным запахом.
3. Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма – порошки, представляющая собой сложный дозированный порошок для внутреннего применения, выписанный распределительным способом. По дисперсологической классификации – свободная всесторонне дисперсная система с твердой дисперсной фазой и газообразной дисперсионной средой (воздух).
5. Проверка доз и норм одноразового отпуска.
В прописи нет наркотических, психотропных, ядовитых, сильнодействующих веществ и веществ списков А и Б, поэтому не проводится проверка доз и норм одноразового отпуска.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ XI изд. «Порошки». Паспорт письменного контроля оформляется в соответствии с приказом МЗ РФ № 214 от 16.07.97.
Общая масса всех ингредиентов порошка 2,1, следовательно, выбираем ступку № 2.
Для определения последовательности смешивания лекарственных веществ в ступке, учитывают, что все лекарственные вещества кристаллические, но выписаны в разных количествах. Тиамина бромид выписан в самом малом количестве, поэтому начинать измельчение с него нецелесообразно. Необходимо рассчитать относительные потери в порах ступки для кислоты аскорбиновой и глюкозы.
Абсолютные потери веществ в ступке № 2
Кислота аскорбиновая: 12 ? 2 = 24 мг
Глюкоза: 7 ? 2 = 14 мг
Относительные потери
Кислота аскорбиновая: 0,6 – 100%
0,024 – х1 х1 = 4%
Глюкоза: 1,2 – 100%
0,014 – х2 х2 = 1,17%
Относительные потери глюкозы меньше, поэтому ее первой помещают в ступку; вторым, по принципу от меньшего к большему, вносят в ступку тиамина бромид. В ступку № 2 помещают глюкозу 1,2 г, измельчают и смешивают с тиамина бромидом 0,3 г. В последнюю очередь добавляют аскорбиновую кислоту – 0,6 г. Проверяют однородность порошка и развешивают с помощью ВР-1 по 0,35 № 6.
8. Упаковка и оформление.
Порошки упаковывают в вощеные капсулы. Лекарственную форму оформляют этикеткой «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены; предупредительной надписью: «Беречь от детей»; наклеивают номер рецепта.
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют друг другу. Расчеты верны.
– Правильность упаковки и оформления. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97. Отдельные дозы аккуратно завернуты в вощеные капсулы, сложены по 3, уложены в пакет.
– Органолептический контроль. Порошок белого цвета, с характерным запахом тиамина бромида.
– Отклонения в массе отдельных порошков. Средняя масса и отклонения в массе порошков находятся в пределах ±5% (0,28±0,01) (приказ МЗ РФ № 305 от 16.10 97г.)
10. Применение.
В качестве витаминного средства.
№ 4.
1. Recipe:
Natrii hydrocarbonatis
Bismuthi subnitratis
Phenylii salicylatis ana 0,25
Misce ut fiat pulvis.
Da tales doses № 6.
Signa:
По 1 порошку 3 раза в день.
1. Свойства ингредиентов.
Natrii hydrocarbonas – (ГФ Х, ст. 430) белый кристаллический порошок без запаха, соленощелочного вкуса, устойчив в сухом воздухе медленно разлагается во влажном воздухе.
Bismuthi subnitras – (ГФ Х, ст. 107) белый аморфный или мелкокристаллический порошок.
Phenylii salicylas – (ГФ Х, ст. 523) белый кристаллический порошок или мелкие кристаллы со слабым запахом.
2. Ингредиенты:
совместимы.
3. Характеристика лекарственной формы.
Твердая лекарственная форма, представляющая собой сложный дозированный порошок для внутреннего применения, выписанный распределительным способом с труднопорошкуемым веществом фенилсалицилатом и веществами натрия гидрокарбонатом кристаллическим, висмута нитрата мелкокристаллическим или аморфным. По дисперсологической классификации – свободная всесторонне дисперсная система с твердой дисперсной фазой и газообразной дисперсионной средой (воздух).
4. Проверка доз и норм одноразового отпуска.
В прописи нет наркотических, психотропных, ядовитых, сильнодействующих веществ и веществ списков А и Б, поэтому не проводится проверка доз и норм одноразового отпуска.
5. Паспорт письменного контроля.
6. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ XI изд. «Порошки». Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97.
Учитывая общую массу ингредиентов порошка 4,5 г, выбирают ступку № 4. Первым в ступке измельчают труднопорошкуемое вещество фенилсалицилат 1,5 г с 15 каплями спирта этилового (на 1 г вещества – 10 капель спирта этилового). Затем добавляют натрия гидрокарбонат, висмута нитрат основной и измельчают до получения однородного порошка. Развешивают на ручных весах ВР-1 по 0,75 на 6 доз.
7. Упаковка и оформление.
Порошки упаковывают в пергаментные капсулы – фенилсалицилат – жирорастворимое вещество. Складывают по 3 порошка и помещают в бумажный пакет. Лекарственную форму оформляют этикеткой «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены; предупредительной надписью: «Беречь от детей»; наклеивают номер рецепта.
8. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют друг с другом. Расчеты верны.
– Правильность упаковки и оформления. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97. Отдельные дозы аккуратно завернуты в пергаментные капсулы, сложены по 3, уложены в пакет.
– Органолептический контроль. Порошки белого цвета, вкус солоноватый.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе отдельных порошков. Средняя масса и отклонения в массе порошков находятся в пределах ±5% (от 0,75±0,03) (приказ МЗ РФ № 305 от 16.10 97г.)
9. Применение.
При желудочно-кишечных заболеваниях в качестве антацидного, вяжущего антисептического средства.
№5.
1. Recipe:
Extracti Belladonnae 0,01
Bismuthi subnitratis 0,1
Sacchari 0,2
Misce ut fiat pulvis.
Da tales doses № 6.
Signa:
По 1 порошку 3 раза в день.
2. Свойства ингредиентов.
Extractum Belladonnae siccum – (ГФ Х, ст. 255) аморфная масса светло-бурого цвета, сп. Б.
Bismuthi subnitras – (ГФ Х, ст. 107) белый аморфный или мелкокристаллический порошок.
Saccharum – (ГФ Х, ст. ) белый кристаллический порошок, сладкого вкуса, легко растворим в воде.
3. Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный дозированный порошок для внутреннего применения с веществом списка Б – экстрактом красавки, выписанный распределительным способом.
5. Проверка доз веществ списков А и Б и норм одноразового отпуска.
Экстракт красавки густой (в прописи не указан какой, значит выписан густой).
В.р.д. = 0,5 В.с.д. = 0,15
Р.д. = 0,01 с.д. = 0,01 ? 3 = 0,03
Дозы не завышены.
Наркотических и приравненных к ним веществ нет.
Рецепт выписан правильно.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Подготовку рабочего места проводят в соответствии с Приказом МЗ РФ № 309 от 21.10.97.
Общая масса порошка 1,92 г. Первым в ступку № 2 помещают 1,2 г сахара и тщательно измельчают (т.к. крупнокристаллическое вещество и прописано в большем количестве). Затем на ручных весах ВР-1 отвешивают 0,6 г висмута нитрата основного, согласно правила от меньшего к большему, смешивают. В последнюю очередь в ступку добавляют 0,12 г экстракта красавки сухого. Порошки тщательно измельчают и смешивают до однородности. Контролируют однородность порошка визуально. Порошки развешивают на 6 доз по 0,32 на весах ВР-1 и упаковывают.
8. Упаковка и оформление.
Порошки упаковывают в парафинированные и вощеные капсулы (экстракт красавки сухой, сахар – гигроскопические вещества), складывают по 3 порошка и помещают в бумажный пакет. Наклеивают номер рецепта, оформляют этикетками: «Внутреннее», «Беречь от детей».
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, паспорт письменного контроля и номер лекарственной формы соответствуют. Ингредиенты совместимы, расчеты сделаны верно.
– Правильность упаковки и оформления. Порошки упакованы в вощенные капсулы, сложены по 3 штуки в пакет. Оформлены этикетками «Внутреннее», «Беречь от детей».
Оформление соответствует Приказу МЗ РФ № 120 от 05.09.97.
– Органолептический контроль. Порошки буроватого цвета, со слабым своеобразным запахом.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Развеска порошков по 0,32 ± 0,016 на 6доз. Отклонения в массе порошков не превышают ± 5% в соответствии с Приказом МЗРФ № 305 от 16.10.97 г. и ГФ ХI.
№6
1. Recipe:
Zinci oxydi 5,0
Acidi borici 1,0
Talci 4,0
Misce, ut fiat pulvis
Da.
Signa:
Присыпка.
2. Свойства ингредиентов.
Zinci oxydum – белый или белый с желтоватым оттенком аморфный порошок без запаха.
Acidi boricum – белый крупнокристаллический порошок, без запаха и вкуса, труднопорошкуемое вещество.
Talcum – очень мелкий белый или слегка сероватый порошок без запаха и вкуса.
3. Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный не дозированный порошок для наружного применения (присыпка) с труднопорошкуемым веществом – борной кислотой.
5. Проверка доз веществ списков «А» и «Б» и норм одноразового отпуска.
В лекарственных формах для наружного применения поверку доз не проводят.
Рецепт выписан правильно, оформлен штампом, печатью лечебно-профилактического предприятия, личной печатью и подписью врача.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Подготовку рабочего места проводят в соответствии с приказом МЗ РФ № 309.
Общая масса порошка 10,0, следовательно, выбираем ступку № 5. В ступке измельчают 1,0 г кислоты борной с 5 каплями этилового спирта (правило Дерягина, эффект Ребиндера), несколько раз снимая капсулатуркой порошковую смесь стенок ступки. Следующим в ступку по принципу «от меньшего к большему» помещаем тальк и цинка оксид, измельчают до получения тонкого, однородного порошка.
Поскольку этот порошок представляет собой присыпку, то порошок просеивают через шелковое сито № 61 с размером отверстий 0,1 мм.
Проверяют на однородность и упаковывают.
8. Упаковка и оформление.
Присыпку упаковывают в баночку с плотно завинчивающейся крышкой. Оформляют этикетками «Наружное», «Беречь от детей».
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют. Ингредиенты совместимы, расчеты сделаны верно. Паспорт письменного контроля выписан верно.
– Правильность упаковки и оформления. Порошок упакован в баночку с завинчивающейся пробкой.
Оформление соответствует приказу МЗ РФ № 120.
– Органолептический контроль. Цвет белый, без запаха и вкуса.
– Однородность порошка. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе. Общая масса порошка 10,0 ± 0,3, что соответствует нормам допустимых отклонений (± 3%) по приказу МЗ РФ № 305.
№ 7
1. Recipe:
Atropini sulfatis 0,0003
Anaesthesini 0,15
Natrii sulfatis 0,2
Misce ut fiat pulvis
Da tules doses № 6
Signa:
По 1 порошку 3 раза в день.
2. Свойства ингредиентов.
Atropini sulfas – белый кристаллический порошок без запаха, Список «А» (ГФ X, ст. 76).
Anaesthesinum – белый кристаллический порошок без запаха, слабо-горького вкуса. Вызывает на языке чувство онемения, список «Б» (ГФ X изд., ст. 55).
Natrii sulfas – бесцветные, прозрачные, выветривающиеся на воздухе кристаллы горько-соленого вкуса (ГФ X. ст. 439).
3.Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный дозированный порошок для внутреннего применения, выписанный распределительным способом с веществом сп. А – атропина сульфатом (менее 0,05 г), с веществом сп. Б – анестезином и кристаллическим веществом – натрия сульфатом.
5. Проверка доз.
– Атропина сульфата:
В.р.д. – 0,001 р.д. – 0,0003
В.с.д. – 0,003 с.д. – 0,0009
Дозы не завышены!
– Анестезина:
В.р.д. – 0,5 р.д. – 0,15
В.с.д. – 1,5 с.д. – 0,45
Дозы не завышены!
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97 г. Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97 г.
Учитывая общую массу порошков выбирают ступку № 2. На ручных весах ВР – 5 отвешивают 1,2 г натрия сульфата, помещают в ступку и измельчают первым – крупно – кристаллическое вещество. Согласно правилам работы с веществами сп «А» провизор – технолог в присутствии фармацевта отвешивает 0,18 г тритурации атропина сульфата (1 : 100) на отдельных весочках ВР-1, кот хранятся в шкафу «А» и отмечает в ППК на оборотной стороне рецепта. Тритурацию помещают в ступку с натрия сульфатом, смешивают. Затем отвешивают 0,9 г анестезина. Измельчают и смешивают до получения однородного порошка. Развешивают на 6 доз по 0,38 г и упаковывают.
8. Упаковка и оформление.
Порошки упаковывают в парафинированные вощеные капсулы (атропина сульфат, натрия сульфат выветривающиеся на воздухе в-ва). Порошки оформляют этикеткой “«Внутреннее» с указанием номера аптеки, ФИО больного, способа применения, даты изготовления, цены. Предупредительные надписи «Обращаться с осторожностью», «Беречь от детей». Лекарственную форму опечатывают сургучной печатью, выписывают сигнатуру, наклеивают номер рецепта. Порошки хранят до отпуска больному в отдельном шкафу.
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют. Расчеты верны.
– Правильность упаковки и оформления. Упаковка и оформление соответствуют требования приказа МЗ РФ № 120 от 05.09.97 г.
– Органолептический контроль. Цвет белый, вкус горьковато-соленый, без запаха.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе порошков. Развеска порошков 0,38 ± 0,019, что соответствует нормам допустимых отклонений (± 5%) по приказу МЗ РФ № 305 от 16.10.97 г.
10. Применение.
Обезболивающее, спазмолитическое средство при желудочно-кишечных заболеваниях.
№ 8.
1. Recipe:
Codeini phosphatis 0,03
Sacchari 0,25
Misce ut fiat pulvis.
Da tales doses № 6.
Signa:
По 1 порошку 2 раза в день.
2. Свойства ингредиентов.
Codeini phosphas – (ГФ Х, ст. 168) белый кристаллический порошок без запаха, горьковатого вкуса. На воздухе выветривается. Легко растворим воде (1: 3,5), мало растворим в спирте.
Saccharum – (ГФ IХ, ст. 425) белый кристаллический порошок, сладкого вкуса, легко растворим в воде.
3. Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный дозированный порошок для внутреннего применения с наркотическим веществом – кодеина фосфатом, выписанный распределительным способом. По дисперсологической классификации – свободная всесторонне дисперсная система с твердой дисперсной фазой и газообразной дисперсионной средой (воздух).
5. Проверка доз и норм одноразового отпуска.
Кодеина фосфат
В.р.д. – 0,1 р.д. – 0,03
В.с.д. – 0,3 с.д. – 0,06
Норма одноразового отпуска кодеина фосфата равна 0,2 г, по рецепту 0,03 ? 6 = 0,18г
Дозы и норма одноразового отпуска кодеина фосфата не завышены.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ XI изд. «Порошки». Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97.
Учитывая общую массу ингредиентов порошка 1,68 г выбирают ступку № 3. Первым в ступку отвешивают 1,5 г сахара и тщательно измельчают (крупнокристаллическое вещество и выписано в большем количестве), затем у провизора-технолога получают 0,18 г кодеина фосфата, измельчают компоненты и смешивают до однородности. Порошок развешивают на ручных весах ВР-1 по 0,28 на 6 доз.
8. Упаковка и оформление.
Порошки упаковывают в вощеные капсулы. Складывают по 3 порошка и помещают в бумажный пакет, который опечатывают сургучной печатью. Лекарственную форму оформляют этикеткой «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены; предупредительными надписями: «Обращаться с осторожностью», «Беречь от детей», выписывают сигнатуру; наклеивают номер рецепта и хранят в отдельном запирающемся шкафу до отпуска больному.
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют друг другу. Расчеты верны.
– Правильность упаковки и оформления. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97.
– Органолептический контроль. Порошки белого цвета, сладкого вкуса, без запаха. Размер частиц не более 0,160 мм.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе отдельных порошков. Средняя масса и отклонения в массе порошков находятся в пределах ±10% (0,28±0,02) (приказ МЗ РФ № 305 от 16.10 97г.)
10. Применение.
Средство от кашля.
№ 9.
1. Recipe:
Platyphyllini hydrotartratis 0,002
Natrii hydrocarbonatis
Magnesii oxydi ana 0,2
Misce ut fiat pulvis.
Da tales doses № 6.
Signa:
По 1 порошку 3 раза в день.
2. Свойства ингредиентов.
Plathyphyllini hydrotartras – (ГФ Х, ст. 541) белый кристаллический порошок без запаха или со слабым своеобразным запахом, горького вкуса.
Natrii hydrocarbonas – (ГФ Х, ст. 430) белый кристаллический порошок, без запаха, солено-щелочного вкуса, устойчив в сухом воздухе, медленно разлагается во влажном.
Magnesii oxydum – (ГФ Х, ст. 380) белый мелкий легкий порошок без запаха.
3. Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный дозированный порошок для внутреннего применения, выписанный распределительным способом, с веществом списка «А»– платифиллина гидротартратом, веществом общего списка – натрия гидрокарбонатом и легко пылящим веществом – магния оксидом. По дисперсологической классификации – свободная всесторонне дисперсная система с твердой дисперсной фазой и газообразной дисперсионной средой (воздух).
5. Проверка доз и норм одноразового отпуска.
Платифиллина гидротартрат – сп.А
В.р.д. – 0,01 р.д. – 0,002
В.с.д. – 0,03 с.д. – 0,006
Дозы не завышены.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ XI изд. «Порошки». Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97.
Учитывая общую массу ингредиентов прописи, (масса магния оксида теоретически удваивается только для выбора ступки) 3,72 (0,12+1,2+1,2?2=3,72), выбирают ступку № 4. На ручных весах ВР-5 отвешивают 1,2 натрия гидрокарбоната, помещают в ступку (соотношение 1,2: 0,12 не превышает 1: 20) и измельчают.
Соблюдая правила работы с веществами списка «А», провизор-технолог в присутствии фармацевта отвешивает 0,12 тритурации (1: 10) платифиллина гидротартрата на отдельных ручных весах ВР-1, которые хранят в шкафу «А» и отмечает количество тритурации в паспорте письменного контроля, и на оборотной стороне рецепта. Тритурацию помещают в ступку с измельченным натрия гидрокарбонатом, тщательно смешивают. Добавляют магния оксид и осторожно перемешивают (пылящее вещество) до однородности порошка. Массу развешивают на ручных весах ВР-1 по 0,42 на 6 доз.
8. Упаковка и оформление.
Порошки упаковывают в парафинированные или вощеные капсулы (натрия гидрокарбонат неустойчив во влажном воздухе – разлагается, магния оксид гигроскопичен). Складывают по 3 порошка и помещают в бумажный пакет, который опечатывают сургучной печатью. Лекарственную форму оформляют этикеткой «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены; предупредительными надписями: «Обращаться с осторожностью», «Беречь от детей», выписывают сигнатуру; наклеивают номер рецепта и хранят в отдельном запирающемся шкафу до отпуска больному.
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют друг другу. Расчеты верны. В рецепте красным карандашом подчеркнуто наименование вещества списка «А», на паспорте письменного контроля и на оборотной стороне рецепта указано количество вещества сп.А и имеются подписи провизора-технолога и фармацевта.
– Правильность упаковки и оформления. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97.
– Органолептический контроль. Порошки белого цвета, горько-солоноватого вкуса.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе отдельных порошков. Средняя масса и отклонения в массе порошков находятся в пределах ±5% (0,42±0,02) (приказ МЗ РФ № 305 от 16.10 97г.)
10. Применение.
Спазмолитическое средство.
№ 10.
1. Recipe:
Camphorae 0,1
Tincturae Leonuri gtt. I
Sacchari 0,2
Misce ut fiat pulvis.
Da tales doses № 6.
Signa:
По 1 порошку 3 раза в день.
2. Свойства ингредиентов.
Camphora – (ГФ Х, ст. 128) белые кристаллические куски, или бесцветный кристаллический порошок. Обладает сильным характерным запахом и пряным горьковатым, затем охлаждающим вкусом.
Tinctura Leonuri – (ГФ Х, ст. 668) прозрачная жидкость зеленовато-бурого цвета, слабо ароматного запаха, горьковатого вкуса.
Saccharum – (ГФ IХ, ст.425) белые кристаллы или белый кристаллический порошок, сладкого вкуса.
3. Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный дозированный порошок для внутреннего применения, выписанный распределительным способом. с труднопорошкуемым веществом – камфорой и крупнокристаллическим веществом – сахаром. По дисперсологической классификации – свободная всесторонне дисперсная система с твердой дисперсной фазой (мелкодисперсные частицы разного размера и формы) и газообразной дисперсионной средой (воздух).
5. Проверка доз и норм одноразового отпуска.
В прописи нет наркотических, психотропных, ядовитых, сильнодействующих веществ и веществ списков А и Б, поэтому не проводится проверка доз и норм одноразового отпуска.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ XI изд. «Порошки». Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97.
Учитывая общую массу выбирают ступку № 2. Камфора относится к труднопорошкуемым веществам, которые измельчаются в присутствии спирта или эфира. В данном рецепте используется настойка пустырника, потому что она готовится на 70% этаноле. При измельчении вещества с жидкостью наблюдается «Эффект Ребиндера». Сущность эффекта состоит в том, что жидкие компоненты облегчают процесс разрушения, и адсорбируясь на мельчайших частицах, препятствуют агрегации, стабилизируют порошковую смесь. Для лекарственных веществ типа камфоры, ментола, фенилсалицилата, пентоксила берут 10 капель спирта или 15 капель эфира на 1 г вещества.
Первым в ступке измельчается труднопорошкуемое вещество – камфора с 6 каплями настойки пустырника. Затем отвешивают 1,2 сахара на ручных весах ВР-5, измельчают с камфорой и смешивают до получения однородного порошка. Массу взвешивают, делят на 6 доз и упаковывают.
8. Упаковка и оформление.
Порошки упаковывают в пергаментные капсулы (камфора летуча и растворима в воске и парафине). Складывают по 3 порошка и помещают в бумажный пакет. Лекарственную форму оформляют этикеткой «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены; предупредительными надписями: «Хранить в прохладном месте», «Беречь от детей»; наклеивают номер рецепта.
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют друг другу. Расчеты верны.
– Правильность упаковки и оформления. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97.
– Органолептический контроль. Порошки зеленоватого цвета, с запахом камфоры, вкус сладко-горьковатый, жгучий.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе отдельных порошков. Средняя масса и отклонения в массе порошков находятся в пределах ±10% (0,3±0,03) (приказ МЗ РФ № 305 от 16.10 97г.)
10. Применение.
Кардиотоническое средство, стимулятор ЦНС.
№ 11.
1. Recipe:
Extracti Belladonnae 0,02
Magnesii oxydi 0,1
Natrii hydrocarbonatis 0,2
Misce ut fiat pulvis.
Da tales doses № 6.
Signa:
По 1 порошку 3 раза в день.
2. Свойства ингредиентов.
Extractum Belladonnae spissum – (ГФ Х, ст. 255) густая масса темно-бурого цвета, своеобразного запаха, сп. Б.
Magnesii oxydum – (ГФ Х, ст. 380) белый мелкий легкий порошок без запаха.
Natrii hydrocarbonas – (ГФ Х, ст. 430) белый кристаллический порошок, без запаха, соленощелочного вкуса, устойчив в сухом воздухе, медленно разлагается во влажном.
3. Ингредиенты
совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный дозированный порошок для внутреннего применения, выписанный распределительным способом. с веществом сп. Б – густым экстрактом красавки, кристаллическим веществом – натрия гидрокарбонатом и пылящим веществом – магния оксидом. По дисперсологической классификации – свободная всесторонне дисперсная система с твердой дисперсной фазой и газообразной дисперсионной средой (воздух).
5. Проверка доз и норм одноразового отпуска.
Экстракт красавки густой Сп.Б.
В.р.д. – 0,05 р.д. – 0,02
В.с.д. – 0,15 с.д. – 0,06 (0,02 ? 3 = 0,06)
Дозы не завышены
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ XI изд. «Порошки». Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97.
Учитывая общую массу порошка (масса магния оксида теоретически удваивается только для выбора ступки – 1,2 + 0,24 + 0,6 ? 2 = 2,64) выбирают ступку № 3. На ручных весах ВР-5 отвешивают 1,2 натрия гидрокарбоната измельчают, затем добавляют 0,24 сухого экстракта красавки (соотношение 1: 20 не превышено) и смешивают. В последнюю очередь добавляют магния оксид (как пылящее вещество) и осторожно перемешивают до получения однородного порошка. Развешивают на ручных весах ВР-1 по 0,34 на 6 доз.
8. Упаковка и оформление.
Порошки упаковывают в вощеные капсулы – экстракт красавки и магния оксид – гигроскопичные вещества, натрия гидрокарбонат неустойчив во влажном воздухе, разлагается. Складывают по 3 порошка и помещают в бумажный пакет. Лекарственную форму оформляют этикеткой «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены; предупредительной надписью: «Беречь от детей»; наклеивают номер рецепта.
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют друг другу. Расчеты верны.
– Правильность упаковки и оформления. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97. Отдельные дозы аккуратно завернуты в вощеные капсулы, сложены по 3, уложены в пакет.
– Органолептический контроль. Порошки буроватого цвета, вкус солоноватый, со слабым своеобразным запахом.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе отдельных порошков. Средняя масса и отклонения в массе порошков находятся в пределах ±5% (от 0,34±0,01) (приказ МЗ РФ № 305 от 16.10 97г.)
10. Применение.
Спазмолитическое и болеутоляющее средство.
№ 12.
1. Recipe:
Magnesii oxydi
Bismuthi subnitratis
Natrii hydrocarbonatis ana 0,3
Misce ut fiat pulvis.
Da tales doses № 6.
Signa:
По 1 порошку 3 раза в день перед едой.
2. Свойства ингредиентов.
Magnesii oxydum – (ГФ Х, ст. 380) белый мелкий легкий порошок без запаха.
Natrii hydrocarbonas – (ГФ Х, ст. 430) белый кристаллический порошок, без запаха, солонощелочного вкуса, устойчив в сухом воздухе, медленно разлагается во влажном.
Bismuthi subnitras – (ГФ Х, ст. 107) – белый аморфный или мелкокристаллический порошок.
3. Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный дозированный порошок для внутреннего применения, выписанный распределительным способом с кристаллическим веществом – натрия гидрокарбонатом, мелкокристаллическим порошком – висмута нитратом и легкопылящим веществом – магния оксидом. По дисперсологической классификации – свободная всесторонне дисперсная система с твердой дисперсной фазой и газообразной дисперсионной средой (воздух).
5. Проверка доз и норм одноразового отпуска.
Веществ списков А и Б в прописи нет.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ XI изд. «Порошки». Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97.
Все вещества прописаны в одинаковых количествах, чтобы определить какое вещество измельчать первым, рассчитывают относительные потери веществ в порах ступки № 5. Общая масса порошка для выбора номера ступки (1,8?2 + 1,8 + 1,8 (масса магния оксида удваивается) = 7,2 г)
Поскольку относительные потери у натрия гидрокарбоната меньше, его первым помещают в ступку и измельчают. Затем добавляют висмута нитрат основной. Последним добавляют магния оксид и осторожно перемешивают (пылящее вещество) до однородного порошка. Развешивают на ручных весах ВР-1 по 0,9 на 6 доз и упаковывают.
8. Упаковка и оформление.
Порошки упаковывают в вощеные капсулы (натрия гидрокарбонат неустойчив во влажном воздухе, магния оксид – гигроскопичен). Складывают по 3 порошка и помещают в бумажный пакет. Лекарственную форму оформляют этикеткой «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены; предупредительной надписью: «Беречь от детей»; наклеивают номер рецепта.
9.Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют друг другу. Расчеты верны.
– Правильность упаковки и оформления. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97. Отдельные дозы аккуратно завернуты в вощеные капсулы, сложены по 3, уложены в пакет.
– Органолептический контроль. Порошки белого цвета, вкус солоноватый, вяжущий.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе отдельных порошков. Средняя масса и отклонения в массе порошков находятся в пределах ±5% (0,9±0,04) (приказ МЗ РФ № 305 от 16.10 97г.)
10.Применение.
Антацидное, вяжущее средство.
№ 13.
1. Recipe:
Zinci oxydi 5,0
Xeroformii 3,0
Talci 4,0
Tannini 2,0
Misce ut fiat pulvis.
Da.
Signa:
Присыпка.
2. Свойства ингредиентов.
Zinci oxydum – (ГФ X, ст. 736) белый или белый с желтоватым оттенком аморфный порошок без запаха.
Xeroformium – (ГФ X, ст. 734) мелкий аморфный порошок желтого цвета со слабым своеобразным запахом.
Talcum – ГФ IX, ст. ) очень мелкий белый или слегка сероватый порошок без запаха и вкуса.
Tanninum – (ГФ X, ст. 658) светло-желтый или буровато-желтый аморфный порошок, со слабым своеобразным запахом, вяжущего вкуса.
3. Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана твердая лекарственная форма, представляющая собой сложный недозированный порошок для наружного применения (присыпка).
5. Проверка доз веществ списков «А» и «Б» и норм одноразового отпуска.
В лекарственных формах для наружного применения проверку доз не проводят.
Рецепт выписан правильно, оформлен штампом, печатью лечебно-профилактического учреждения, личной печатью и подписью врача.
6.Паспорт письменного контроля.
6. Технология лекарственной формы с теоретическим обоснованием.
Подготовку рабочего места ведут в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ XI изд. «Порошки». Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97.
Учитывая общую массу порошков, (14,0 г) выбирают ступку № 5. На ручных весах ВР-5 отвешивают 5,0 г цинка сульфата, помещают в ступку (соотношение 5 : 2 не превышает 1 : 20) и измельчают первым, потому что это – аморфное вещество, требующее измельчения, его потери в порах ступки наименьшее, а масса наибольшая.
Затем на весах ВР-5 отвешивают 2,0 г танина и помещают в ступку, измельчают и смешивают. Затем на ВР-5 отвешивают 3,0 г ксероформа, помещают в ступку, измельчают и смешивают. (Все порошки в прописи – аморфные вещества, поэтому их добавляют после измельчения цинка оксида по принципу «от меньшего к большему»). Последними отвешивают на ВР-5 4,0 г талька. Тальк не нуждается в измельчении, поэтому его смешивают с компонентами прописи до получения однородного по цвету порошка. Готовый порошок просеивают через шелковое сито № 61 с размером отверстий 0,1 мм. Упаковывают.
8. Упаковка и оформление.
Присыпку упаковывают в баночку с плотно завинчивающейся крышкой. Оформляют этикетками «Наружное», «Беречь от детей».
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, ППК и номер лекарственной формы соответствуют друг другу. Паспорт письменного контроля выписан верно.
– Правильность упаковки и оформления. Порошок упакован в баночку с завинчивающейся крышкой. Оформление соответствует приказу МЗ РФ № 120.
– Органолептический контроль. Цвет светло-желтый, запах своеобразный.
– Однородность порошков. Визуально (при надавливании пестиком на порошковую смесь) не обнаруживается отдельных видимых частиц.
– Отклонения в массе. Общая масса порошка 14,0 ± 0,42, что соответствует нормам допустимых отклонений (±3%) по приказу МЗ РФ № 305.
10. Применение.
Подсушивающее, антимикробное средство.
№14.
1. Recipe:
Codeini phosphatis 0,15
Natrii bromidi 2,0
Natrii benzoatis 3,0
Aquae purificatae 180 ml
Misce.
Da.
Signa:
По 1 столовой ложке 3 раза в день.
2. Свойства ингредиентов.
Codeini phosphas (ГФ Х, ст. 168) – белый кристаллический порошок, без запаха, горького вкуса, растворим в воде.
Natrii bromidum (ГФ Х, ст. 435) – белый кристаллический порошок, без запаха, соленого вкуса, гигроскопичен, растворим в воде.
Natrii benzoatis – (ГФ Х, ст.424) – белый кристаллический порошок, сладковато-соленого вкуса, легко растворим в воде.
3. Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана жидкая лекарственная форма для внутреннего применения, представляющая собой истинный водный раствор лекарственных веществ – кодеина фосфата (наркотическое вещество Приказ МЗ РФ № 330 от 12.11.97), натрия бромида (светочувствительное вещество) и натрия бензоата (легко растворимое вещество).
5. Проверка доз и норм одноразового отпуска.
– Кодеина фосфат – наркотическое вещество
В.р.д. 0,1 В.с.д. 0,3
Общий объем лекарственной формы – 180 мл
Число приемов – 180 : 15 = 12
р.д. (0,15: 12) = 0,012
с.д. (0,012 ? 3) = 0,036
Норма одноразового отпуска 0,2г, в рецепте – 0,15г
Дозы и норма отпуска не завышены. Рецепт выписан правильно, оформлен штампом и печатью ЛПУ «Для рецептов», личной печатью и подписью врача. Кодеина фосфат в рецепте подчеркивают красным карандашом.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97. Изготовление лекарственной формы ведут в соответствии с требованиями приказа МЗ РФ № 308 от 21.10.97. и № 214 от 16.07.97.
В рецепте прописаны растворы веществ, дающих труднорастворимые соединения и взаимно ухудшающие растворимость – кодеина фосфат и натрия бромид. При растворении натрия бромида, а затем кодеина фосфата может наблюдаться выпадение осадка кодеина бромгидрата, растворимость которого 1 : 100. В растворе образуется избыток бром-ионов. Согласно правилу Нернста, при растворении солей с одноименными ионами растворимость соли, взятой в меньшем количестве, ухудшается. Можно растворить порознь вещества и слить растворы или растворить первым кодеина фосфат.
Варианты изготовления прописи:
№1. Воду разделить на две части. В первой части растворить кодеина фосфат, во второй – натрия бромид и натрия бензоат. Затем оба раствора смешать.
№2. В первую очередь в воде растворить кодеина фосфат, а затем натрия бромид.
Изготовление прописи с использованием концентрированных растворов
В подставку отмеривают 140 мл воды очищенной. Согласно требованиям приказов МЗ РФ № 328 от 21.10.99. и № 330 от 12.11.97. (Правила работы с наркотическими веществами) – провизор-технолог в присутствии ассистента отвешивает 0,15 г кодеина фосфата (на отдельных ручных весах), взяв его из сейфа «А».
На оборотной стороне рецепта и в ППК провизор-технолог делает отметку о выдаче кодеина фосфата – 0,15 г, а ассистент – о его получении. Отвешенное количество кодеина фосфата немедленно растворяют в подставке, в воде очищенной. Фильтруют раствор кодеина фосфата через складчатый бумажный фильтр с подложенным комочком ваты во флакон для отпуска. Во флакон для отпуска оранжевого стекла отмеривают из бюреточной установки 10 мл 20% раствора натрия бромида, 30 мл 10% раствора натрия бензоата и перемешивают.
8. Упаковка и оформление.
Флакон оранжевого стекла с микстурой укупоривают пластмассовой пробкой и навинчивающейся крышкой, наклеивают этикетку «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены; предупредительные надписи: «Хранить в прохладном, защищенном от света месте», «Обращаться с осторожностью», «Беречь от детей»; наклеивают номер рецепта. Флакон опечатывают сургучной печатью, выписывают сигнатуру, которую отдают больному вместо рецепта. Хранят лекарственную форму в закрывающемся на ключ шкафу до выдачи больному.
9. Оценка качества.
– Анализ документации. Имеющийся рецепт, сигнатура, ППК и номер лекарственной формы соответствуют. Ингредиенты совместимы, нормы одноразового отпуска кодеина фосфата и его дозы не завышены. Расчеты сделаны верно.
– Правильность упаковки и оформления. Объем флакона оранжевого стекла соответствует объему лекарственной формы. Лекарственная форма укупорена плотно. Упаковка и оформление соответствуют требованиям приказа МЗ РФ № 120 от 05.09.97.
– Органолептический контроль. Бесцветная прозрачная жидкость сладковато-соленого вкуса, без запаха.
– Механические включения отсутствуют.
– Объем лекарственной формы 180 мл ± 3,6 мл, что соответствует нормам допустимых отклонений (±2%) (приказ МЗ РФ № 305 от 16.10 97г.).
10. Применение.
Средство от кашля.
№ 15
1. Recipe:
Solutionis Gelatinae 4% 100 ml
Sirupi simplicis 5 ml
Misce. Da.
Signa:
По 1 столовой ложке через один час.
2. Свойства ингредиентов.
Gelatina medicinalis – (ГФ Х ст. 309) – ВМС, бесцветные или слегка желтоватые просвечивающие гибкие листочки или мелкие пластинки без запаха. Практически не растворим в холодной воде, но набухает, поглощая воду. Растворим после набухания в горячей воде.
Sirupus Simplex (ГФ Х, ст. 615) – прозрачная бесцветная или слабо желтого цвета, светочувствительная, густоватая жидкость сладкого вкуса, без запаха, содержит 64 части сахара и 36 частей воды.
3. Ингредиенты:
совместимы.
4. Характеристика лекарственной формы.
Выписана жидкая лекарственная форма для внутреннего применения, представляющая собой комбинированный водный раствор ограниченно набухающего ВМС – желатина и истинный раствор, образующийся при растворении сахарного сиропа. По дисперсологической классификации – это свободная всесторонне-дисперсная система с жидкой дисперсионной средой.
5. Проверка доз и норм одноразового отпуска.
Проверка доз не проводится, так как в рецепте нет веществ списков А и Б.
6. Паспорт письменного контроля.
7. Технология лекарственной формы с теоретическим обоснованием.
Рабочее место оборудуется и подготавливается в соответствии с требованиями приказа МЗ РФ № 309 от 21.10.97 г. Изготовление ведут в соответствии с требованиями приказа МЗ РФ № 308 от 21.10.97 г.
Паспорт письменного контроля оформляется на основании приказа МЗ РФ № 214 от 16.07.97 г.
Объем раствора складывается из 100 мл раствора желатина и 5 мл сахарного сиропа и равен 105 мл. Сmax = 4%, С% в рецепте
Источник