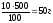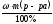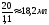Техника приготовления первичных стандартных растворов.
Первичные растворы готовят в мерных колбах. В горлышко колбы вставляют чистую сухую воронку. Взвешивают на аналитических весах чистый, сухой бюкс или весовой стаканчик с точностью до 0.0002 г, переносят его на технические весы и отвешивают рассчитанное количество стандартного вещества. После этого бюкс с веществом взвешивают на аналитических весах. Нет необходимости добиваться, чтобы взятая навеска точно соответствовала рассчитанной. Важно знать ее истинную величину.
Навеску вещества осторожно, не распыляя, пересыпают через воронку в
колбу и очень тщательно многократно ополаскивают водой стенки бюкса над воронкой. Ополаскивают воронку и вынимают ее из горлышка колбы. Доводят объем раствора до метки. Держат колбу таким образом, чтобы метка и глаза наблюдателя были на одном уровне. Затем определяют титр (Т) путем деления массы навески (в граммах) на емкость колбы ( в мл ):
На практике концентрацию титранта чаще всего выражают через эквивалентную (нормальную) концентрацию — N. Зная титр, находят нормальность:
N = 1000 Т /Э
Указанным способом готовят титрованные растворы щавелевой кислоты
Титрованные растворы готовят и из фиксаналов. Фиксаналы — изготовленные в заводских условиях стеклянные ампулы, содержащие определенное количество эквивалентов химических чистого вещества в сухом виде или в растворе.
Для приготовления титрованного раствора из фиксанала содержимое ампулы переносят в мерную колбу и разбавляют дистиллированной водой, доводя объем до метки.
Стандартизированные растворы
Стандартизированные растворы – это растворы, титр которых определяют по стандартному раствору (раствор вторичного стандарта).
При приготовлении этих растворов нет необходимости брать точную навеску вещества, т.к. при всей тщательности взвешивания нельзя получит раствор с известной концентрацией. Например, щелочи всегда содержат неопределенное количество воды и карбоната, и как бы точно не была взята навеска, получить раствор с известной концентрацией невозможно. Поэтому точную концентрацию растворов вторичного стандарта устанавливают титрованием с помощью первичного стандартного раствора.
Процесс определения концентрации вторичного стандартного раствора титрованием по первичному стандартному раствору ( иногда и по вторичному ) называется стандартизациейраствора.
Стандартизация заключается в постепенном прибавлении из бюретки одного раствора к другому, находящемуся в конической колбе. Добавление раствора из бюретки проводят до изменения окраски соответствующего индикатора. При стандартизации каждое титрование проводят не менее трех раз. При этом расхождение не должно превышать 0.1 мл.
Вычисления в титриметрическом анализе.
По затраченному объему титранта и его концентрации вычисляют результат анализа. Вычисление концентрации стандартизированного раствора производится согласно закону химических эквивалентов: растворы различной концентрации реагируют между собой в объемах, обратно пропорциональных их нормальностям:
где N1 , V1 — нормальность и объем раствора одного вещества,
N2 ,V2 — нормальность и объем раствора другого вещества.
Отсюда нормальность одного из веществ можно найти по формуле:
Пример.Определить нормальность азотной кислоты, если на нейтрализацию 20 мл 0.2 н раствора едкого натра потребовалось 25 мл раствора азотной кислоты.
Решение. Нормальность раствора НNO3 определяют по формуле:
N HNO3 . VHNO3= NNaOH . VNaOH
NHNO3 = 0.2 . 20 / 25 = 0.16 моль/л
Техника работы.
Мерные колбы.Мерные колбы служат для приготовления стандартных растворов и для разбавления исследуемых растворов до определенного объема.
Это плоскодонные колбы с длинным, узким горлом, на котором нанесена круговая метка. Колбы калибруют на содержание в них определенного объема жидкости. Объем указан на стенке колбы и соответствует объему жидкости, если колба наполнена таким образом, чтобы нижняя часть мениска жидкости касается метки. При этом глаза наблюдателя и метка должны находиться на одном уровне. Мерные колбы различаются по вместимости: 25, 50, 100, 200, 250, 500 и 1000 мл.
Бюретки. Бюретки позволяют отмерять нужные объемы жидкости, и калиброваны на выливание. Обычные лабораторные макробюретки представляют собой градуированные цилиндрические трубки с суженным концом, который снабжен специальным краном. Суженный конец может быть соединен резиновой трубкой с оттянутой стеклянной трубочкой. По вместимости бюретки бывают от 10 до 100 мл. Их калибруют в мл и их десятых долях (т.е. каждое маленькое деление соответствует 0.1 мл). Нулевое деление находится в верхней части бюретки.
Бюретку закрепляют строго вертикально в штативе и заполняют раствором до уровня превышающую нулевую отметку на 2-3 см. В бюретке не должно быть пузырьков воздуха, особенно часто они возникают в суженной ее части. Для удаления пузырьков воздуха из бюретки дают вытечь части раствора сильной струей.
В процессе титрования выливать жидкость из бюретки следует постепенно; после окончания титрования отсчет объема раствора производится не сразу, для того, чтобы жидкость, оставшаяся на стенке бюретки успела стечь.
Пипетки. Пипетки применяются для точного отмеривания определенного объема раствора и перенесения его из одного сосуда в другой. Они бывают двух типов: градуированные и мерные. Мерные пипетки наиболее часто применяют в титриметрии. Это узкие трубки с расширением в середине. В верхней, узкой части находится круговая метка. Пипетки бывают разной вместимости: 10,15, 20, 25,50 мл. Пипетки калиброваны на выливание. После переноса пипетки в приготовленный для работы сосуд для титрования необходимо дать жидкости вытечь. После этого прикасаются кончиком пипетки к стенке сосуда и ждут 20 секунд, пока вытекут остатки. Не следует обращать внимание на небольшое количество раствора в носике. Калибрование пипетки рассчитано именно на этот способ выливания. Выдувание оставшейся в пипетке капли раствора недопустимо.
Источник
1.4.Способы приготовления растворов. Способы приготовления стандартных растворов.
Растворы с известной концентрацией, которые служат для определения концентрации других растворов, называются стандартными или рабочими. Это некоторые растворы кислот, щелочей, солей.
Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям:
— вещество должно быть чистым
— иметь постоянный состав
— быть устойчивым как на воздухе так и в растворе
— иметь достаточно высокую молекулярную массу.
Такие соединения называются установочными. К ним относятся: щавелевая кислота (Н2С2О4 · 2Н2О), тетраборат натрия (бура) (Na2B4O7 · 12H2O), дихромат калия (K2Cr2O7). Для веществ, неудовлетворяющих требованиям, растворы готовят методом неточной навески или разбавлением.
Метод неточной или приблизительной навески. Предполагает работу с растворами, которые не соответствуют этим требованиям, например, меняют свою массу на воздухе, например, перманганат калия. Перед применением их в качестве стандартных растворов, необходимо оттитровать другим раствором с точно известной концентрацией.
Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал — ампула с сухим веществом или раствором с точно известной концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным.
1.5.Решение задач на приготовление растворов с массовой долей (%) концентрации.
Задача 1. Приготовить 500 г раствора С6Н12О6 с массовой долей равной 10% ?
m (р-ра С6Н12О6) = 500 г
__________________ формуле: m (в-ва) =
Найти: m (С6Н12О6) = ? m (С6Н12О6) =
2. Определяем массу воды согласно формуле:
m (р-ра) = m (р-ля) + m (вещ-ва), m (Н2О) = m (р-ра) – m (в-ва),
m (H2O) = 500 – 50 = 450 г.
Согласно формуле: 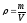

Ответ: чтобы приготовить 500 г раствора глюкозы с массовой долей 10%, необходимо отвесить на весах 50 г глюкозы, отмерить любой мерной посудой 450 мл воды, поместить этот раствор в колбу и перемешать.
Задача 2. Приготовить 800 мл раствора NaCl с массовой долей равной 12% и плотностью равной 1,1 г/мл?
V (р-ра) = 800 мл
ρ = 1,1 г/мл 1. Определяем массу р-ра NaCl согласно
__________________ формуле: m (р-ра)= V ∙ ρ = 800 мл · 1,1г/мл = 880 г
2. Определяем массу NaCl согласно формуле: m (в-ва) =
m (NaCl) =
3. Определяем массу воды согласно формуле:
m (Н2О) = m (р-ра) – m (в-ва), ), m (Н2О) = 880 – 105,6 = 774,4 г или 774,4 мл, т.к. плотность воды равна 1 г/мл.
Ответ: для приготовления 800 мл раствора хлорида натрия с массовой долей равной 12 %, необходимо отвесить на весах 105,6 г NaCl, отмерить любой мерным цилиндром 774,4 мл воды, поместить раствор в колбу и перемешать.
Задача 3 Приготовить 100 г ра-ра MgSO4 c ω = 2 % из р-ра MgSO4 c ω = 10 % ?
ω1( MgSO4) = 10 %
ρ = 1,1 г/мл 1. Определяем массу чистого MgSO4
__________________ содержащегося в 100 г 2 % р-ра MgSO4
Найти: m 1 ( MgSO4) = ? m (в-ва) = 
m (H2O) = ? m (MgSO4) =
2. Определяем массу р-ра MgSO4 (исходного) с ω = 10 % содержащего 2 г чистого MgSO4 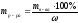
3. Определяем объём исходного (первого) р-ра MgSO4 с ω = 10 %
Vр-ра = 
4. Определяем массу Н2О, которая необходима для разбавления исходного раствора MgSO4.
m (H2O) = 100 – 20 = 80 г или для чистой воды 80 мл.
Ответ: для приготовления 100 г раствора MgSO4 с массовой долей равной
2 % из раствора MgSO4 с массовой долей 10 % и ρ = 1,1 г/мл, необходимо отмерить из бюретки 18,2 мл 10 % р-ра MgSO4, поместить их в колбу, добавить туда цилиндром 80 мл воды и перемешать.
Источник
Способы приготовления стандартных растворов



Растворы с известной концентрацией, которые служат для определения концентрации других растворов, называются стандартными или рабочими. Это некоторые растворы кислот, щелочей, солей.
1. Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом. К таким веществам относятся щавелевая кислота, сода, бура (Na2B4O7·10H2O), бихромат калия и ряд других веществ. На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям:
— вещество должно быть чистым
— иметь постоянный состав
— быть устойчивым как на воздухе так и в растворе
— иметь достаточно высокую молекулярную массу.
Такие соединения называются установочными. К ним относятся: щавелевая кислота (Н2С2О4 · 2Н2О), тетраборат натрия (бура) (Na2B4O7 · 12H2O), дихромат калия (K2Cr2O7). Для веществ, неудовлетворяющих требованиям, растворы готовят методом неточной навески или разбавлением.
2. Метод неточной или приблизительной навески. Предполагает работу с растворами, которые не соответствуют этим требованиям, например, меняют свою массу на воздухе, например, перманганат калия. Перед применением их в качестве стандартных растворов, необходимо оттитровать другим раствором с точно известной концентрацией.
3. Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
4. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал — ампула с сухим веществом или раствором с точно известной концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным.
1.5.Решение задач на приготовление растворов с массовой долей (%) концентрации.
Задача 1. Приготовить 500 г раствора С6Н12О6 с массовой долей равной 10% ?
m (р-ра С6Н12О6) = 500 г
__________________ формуле: m (в-ва) =
Найти: m (С6Н12О6) = ? m (С6Н12О6) =
2. Определяем массу воды согласно формуле:
m (р-ра) = m (р-ля) + m (вещ-ва), m (Н2О) = m (р-ра) – m (в-ва),
m (H2O) = 500 – 50 = 450 г.
Согласно формуле: 

Ответ: чтобы приготовить 500 г раствора глюкозы с массовой долей 10%, необходимо отвесить на весах 50 г глюкозы, отмерить любой мерной посудой 450 мл воды, поместить этот раствор в колбу и перемешать.
Задача 2. Приготовить 800 мл раствора NaCl с массовой долей равной 12% и плотностью равной 1,1 г/мл?
V (р-ра) = 800 мл
ρ = 1,1 г/мл 1. Определяем массу р-ра NaCl согласно
__________________ формуле: m (р-ра)= V ∙ ρ = 800 мл · 1,1г/мл = 880 г
2. Определяем массу NaCl согласно формуле: m (в-ва) =
m (NaCl) =
3. Определяем массу воды согласно формуле:
m (Н2О) = m (р-ра) – m (в-ва), ), m (Н2О) = 880 – 105,6 = 774,4 г или 774,4 мл, т.к. плотность воды равна 1 г/мл.
Ответ: для приготовления 800 мл раствора хлорида натрия с массовой долей равной 12 %, необходимо отвесить на весах 105,6 г NaCl, отмерить любой мерным цилиндром 774,4 мл воды, поместить раствор в колбу и перемешать.
Задача 3 Приготовить 100 г ра-ра MgSO4 c ω = 2 % из р-ра MgSO4 c ω = 10 % ?
ω1( MgSO4) = 10 %
ρ = 1,1 г/мл 1. Определяем массу чистого MgSO4
__________________ содержащегося в 100 г 2 % р-ра MgSO4
Найти: m 1 ( MgSO4) = ? m (в-ва) = 
m (H2O) = ? m (MgSO4) =
2. Определяем массу р-ра MgSO4 (исходного) с ω = 10 % содержащего 2 г чистого MgSO4 
3. Определяем объём исходного (первого) р-ра MgSO4 с ω = 10 %
Vр-ра = 
4. Определяем массу Н2О, которая необходима для разбавления исходного раствора MgSO4.

m (H2O) = 100 – 20 = 80 г или для чистой воды 80 мл.
Ответ: для приготовления 100 г раствора MgSO4 с массовой долей равной
2 % из раствора MgSO4 с массовой долей 10 % и ρ = 1,1 г/мл, необходимо отмерить из бюретки 18,2 мл 10 % р-ра MgSO4, поместить их в колбу, добавить туда цилиндром 80 мл воды и перемешать.
Источник