АЛГОРИТМ ВНУТРИАПТЕЧНОГО КОНТРОЛЯ ТРИТУРАЦИИ ДИМЕДРОЛА 1:10
• Работа с рецептом не проводится
Проверить запись в книге учета лабораторных и фасовочных работ.
Сахар молочный — 9.0
Поставить № анализа: Подпись провизора-аналитика:
Белый однородный сыпучий порошок.
• Физический контроль не проводится.
По приказу М3 РФ № 214 от 16.07.97 тритурации подлежат полному химическому контролю обязательно.
• на основание димедрола (реакция образования оксониевой соли);
• на сахар (с раствором нитрата кобальта).
Количественное определение: метод нейтрализации в спирто-хлоро- формной среде
m димедрола = 1,0 доп.отк = ± 5%
• Оформление результатов анализа:
• заполнить «Журнал регистрации результатов органолептического, физического и химического контроля внутриаптечной заготовки, лекарственных форм, изготовленных по индивидуальным рецептам (требованиям лечебных учреждений), концентратов, полуфабрикатов, тритураций, спирта этилового и фасовки»;
• поставить номер анализа и подпись в книге учета лабораторнофасовочных работ и на этикетке.
• Контроль при отпуске — больным не отпускают.
Контроль состоит в проверке правильности оформления штангласа для ассистентской. На штангласе должна быть четкая и полная надпись: TrituratioDimedrolicumSaccharolactatis1:10 1 часть Dimedroli+ 9 частей Saccharilactatis 0,01 г Dimedroli= 0,1 г TriturationisДата:
Хранят тритурацию димедрола в сухом, защищенном от света месте.
ЗАНЯТИЕ 4
ВНУТРИАПТЕЧНЫЙ КОНТРОЛЬ СЛОЖНЫХ ДОЗИРОВАННЫХ ПОРОШКОВ АСКОРБИНОВОЙ КИСЛОТЫ
Задачи
• Освоить внутриаптечный контроль сложных дозированных порошков.
• Научиться проводить химический контроль сложной лекарственной формы с учетом влияния ее компонентов на анализ друг друга.
• Совершенствовать навыки проведения необходимых расчетов и оформления результатов анализа.
Продолжительность занятия
2 академических часа
Вопросы
для самоподготовки
• Составьте алгоритм внутриаптечного контроля сложных дозированных порошков аскорбиновой кислоты и глюкозы.
• Влияют ли компоненты смеси на качественный анализ друг друга? Назовите фактор влияния. Какой прием используют при идентификации глюкозы?
• Влияют ли компоненты смеси на количественный анализ друг друга? Приведите методики количественного определения аскорбиновой кислоты и глюкозы при их совместном присутствии.
• Расчеты содержания действующих веществ, титра, ориентировочного объема титранта. Оформление результатов контроля.
Материальное обеспечение
• кислота хлористоводородная, кислота серная разведенная;
• кислота серная концентрированная;
• жидкость Фелинга; тимол (кристаллический).
Титрованные растворы и индикаторы:
• 0,1 моль/л раствор иода;
• 0,1 моль/л раствор натрия гидроксида;
• 0,1 моль/л раствор натрия тиосульфата;
Посуда, приборы, оборудование:
• ручные весочки и разновес;
• склянки с притертой пробкой;
• цилиндры на 10 мл;
Rp: Acidi ascorbinici 0,1
Misce fiat pulvis.
Da tales doses № 10
S. По одному порошку 3 раза в день.
Свойства
Белый сыпучий однородный порошок, без запаха, сладковато-кислого вкуса. Растворим в воде.
Подлинность
• На аскорбиновую кислоту
•
у-лактон-2,3-дегидро- L-гулоновой кислоты
Реакции подлинности на аскорбиновую кислоту основаны на ее сильно выраженных восстановительных свойствах. При этом енольная форма окисляется и переходит в кетонную (процесс сопровождается подкислением
енольная форма кетоформа
аскорбиновая кислота дегидроаскорбиновая кислота
а) реакция с раствором нитрата серебра
0,01 г порошка растворяют в 0,5 мл воды и прибавляют 2 капли раствора нитрата серебра. Выпадает черный осадок.
б) реакция с реактивом Фелинга
0,01 г препарата нагревают с реактивом Фелинга. Наблюдают выделение кирпично-красного осадка.
в) реакция с хлоридом окисного железа и феррицианидом калия
К раствору препарата прибавляют 1-2 капли раствора хлорида окисного железа. Происходит восстановление железа (III) до железа ( II ).
После прибавления к раствору одной капли раствора феррицианида калия появляется синее окрашивание (образование турнбулевой сини)
а) реакция на глюкозу также основана на восстановительной способности. Но глюкоза более слабый восстановитель. Аскорбиновая кислота мешает определению глюкозы, поэтому для идентификации глюкозы необходимо предварительно окислить аскорбиновую кислоту. С этой целью 0,05 г препарата растворяют в 1 мл воды, добавляют 5 капель пергидроля и кипятят 2-3 минуты. В этих условиях енольная форма аскорбиновой кислоты окисляется до кетоформ
Для нейтрализации продуктов реакции добавляют 2-3 капли раствора аммиака.
Затем проводят качественную реакцию на глюкозу с реактивом Фелинга. Раствор кипятят с 0,5 мл реактива Фелинга. Наблюдают образование кирпично-красною окрашивания.
б) реакция с тимолом в среде концентрированной серной кислоты К 0,01 г порошка прибавляют 0,01 г тимола, 5-6 капель концентрированной серной кислоты, 1-2 капли воды. Появляется темно-красное окрашивание. Этой реакции на глюкозу не мешает присутствие аскорбиновой кислоты.
Количественное определение
Количественное определение компонентов проводят ступенчато в одной навеске, использую их разную восстановительную способность.
Аскорбиновая кислота как наиболее сильный восстановитель может окисляться даже таким слабым окислителем, как 0,1 моль/л раствор иода. При этом енольная форма аскорбиновой кислоты переходит в кетонную без разрыва лактонного кольца. Количественное определение аскорбиновой кислоты проводят методом иодометрии (прямое титрование). Глюкоза в этих условиях не титруется (не окисляется).
После снятия точки эквивалентности для аскорбиновой кислоты меняют условия титрования. Теперь окислителем выступает иод в щелочной среде. Образующийся гипоиодит натрия (сильный окислитель) способен окислить и глюкозу. Для титрования глюкозы используют метод иодометрии в щелочной среде (обратное титрование).
• Количественное определение аскорбиновой кислоты
МетиО иодометрии (прямое титрование)
0,1 г порошка растворяют в 10 мл воды в склянке с притертой пробкой (почему?) и титруют 0,1 моль/л раствором иода до желтого окрашивания без индикатора (почему?). Записать количество мл 0,1 моль/л раствора J2, ушедших на титрование
М аскорбиновой к-ты= 176,13 г/ моль f= 1/2
T = M* f * cf = 176 *1|2 * 0,1 = 0,0088 г/мл
Vориентир.= m = 0,02 = 2,27 мл ( в одной дозе 0,5 г содержится 0.1г аскорбиновой кислоты, а в
Т 0,0088 0,1 г порошка Х г аскорбиновой кислоты .
Х = 0,1 * 0,1 =0,02 — столько содержится аскорбин.
0,5 кислоты во взятой на титрование
mаскорб. к-ты = V*K * T* A
навеска , где А — масса одного порошка ( 0,5г)
допустимые нормы отклонения = ? ( таблица 4 )
• Количественное определение глюкозы
Метод иодометрии в щелочной среде (обратное титрование)
К выше оттитрованному раствору прибавляют по бюретке 20 мл 0.1 моль/л раствора иода, 10-15 мл 1% или 30 40 мл 0,1 моль/л раствора гидроксида натрия, оставляют стоять в темном месте 15 минут. При этом глюкоза окисляется до глюконовой кислоты.
R-COH + NaOI + NaOH = R-COONa + NaI +H2O
Затем прибавляют 10 мл разведенной серной кислоты и выделившийся иод оттитровывают 0,1 моль/л раствором тиосульфата натрия. Титрование ведут сначала до соломенно-желтого окрашивания, затем добавляют 8-10 капель крахмала и продолжают титровать до обесцвечивания.
1 мл 0,1 моль/л раствора иода соответствует 0,0099 г глюкозы.
• Количественное определение аскорбиновой кислоты \
0,05 г порошка растворяют в 2 мл воды и титруют 0,1 моль/л раство-
ром гидроксида натрия до розового окрашивания. Индикатор — 3-4 капли
фенолфталеина
Маскорбин. к-ты =176,13 г/моль f аскорб. к-ты = 1
ЗАНЯТИЕ 5
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ (СОЛИ, ЛАКТОНЫ). АМИНОКИСЛОТЫ. ВНУТРИАПТЕЧНЫЙ КОНТРОЛЬ ВНУТРИАПТЕЧНОЙ ЗАГОТОВКИ РАСТВОРА КАЛЬЦИЯ ГЛЮКОНАТА 5% — 100 МЛ № 30
Задачи
• Коррекция и совершенствование знаний по теме «Карбоновые кислоты и их производные (соли, лактоны). Аминокислоты».
• Совершенствование знаний, умений и навыков проведения внутри- антечного контроля внутриаптечной заготовки.
• Освоить химический контроль кальция глюконата.
Продолжительность занятия
2 академических часа (90 минут)
Вопросы для самоподготовки
• Связь между химическим строением карбоновых кислот, аминокислот и их действием на организм. Русские, латинские, химические названия, способы получения, подлинность, испытания на чистоту, количественное определение, применение, хранение и отпуск лекарственных препаратов: натрия цитрата для инъекций, натрия гидроцитрата для инъекций, кальция глюконата, кислоты аскорбиновой, кислоты глютаминовой, кислоты аминокапроновой.
• Особенности внутриаптечного контроля внутриаптечной заготовки. Составьте алгоритм внутриаптечного контроля внутриаптечной заготовки и фасовки раствора кальция глюконата 5% — 100 мл № 30.
• Химический контроль внутриаптечной заготовки раствора кальция глюконата. Особенности расчетов. Оформление результатов контроля.
Материальное обеспечение
• раствор оксалата аммония;
• раствор трихлорида железа;
• аммиачный буферный раствор.
Титрованные растворы и индикаторы:
• 0.05М раствор трилона Б;
• раствор кислотного хром темно-синего.
Посуда, приборы, оборудование:
• набор глазных пипеток;
• колба для титрования;
• мерный цилиндр на 10 мл;
• часовое (предметное) стекло;
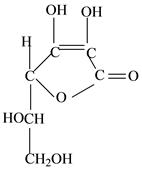
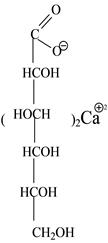
Solutio Calcii gluconatis 5% — 100 ml № 30
Внутриаптечная заготовка и фасовка
Свойства
Бесцветная прозрачная жидкость без запаха и вкуса, нейтральной реакции среды.
Подлинность
К 3-5 каплям раствора на часовом стекле прибавляют 1-2 капли раствора оксалата аммония. Наблюдают белый осадок, растворимый в минеральных кислотах и нерастворимый в уксусной кислоте и растворе аммиака.
К 3-5 каплям раствора прибавляют 2 капли раствора хлорида окисного железа. Наблюдают светло-желтое окрашивание.
Количественное определение
• Метод комплексонометрии (тржонометрии)
К 1 мл препарата добавляют 5 мл аммиачного буферного раствора, 5 — 7 капель индикатора кислотного хром темно-синего и титруют 0,05 М раствором трилона Б до перехода ало-красного окрашивания в сине-фиолетовый цвет.
1 мл 0,05 М раствора трилона Б соответствует 0,02242 г глюконата кальция.
m = V • К • Т * 3000
доп.отк = ±3% !
Vориент= m = 0,05 =1,19 мл 0,05 г глюконата кальция, которая содержится в 1 мл
T 0,02242 анализ. р-ра
• Рефрактометрический метод С% = п — п„
F 5%ppa = 0,00166 доп. отк. =±4%!
АЛГОРИТМ ВНУТРИАПТЕЧНОГО КОНТРОЛЯ ВНУТРИАПТЕЧНОЙ ЗАГОТОВКИ И ФАСОВКИ РАСТВОРА КАЛЬЦИЯ ГЛЮКОНАТА 5% — 100 МЛ № 30
Проверяется запись в книге учета лабораторных и фасовочных работ:
Кальция глюконата 150,0 КУО = 0,5
Воды очищенной 2925 мл
Раствор кальция глюконата 5% — 100 мл № 30 Поставить:
Бесцветная прозрачная жидкость без механических включений.
Количество флаконов — 30. Проверка качества укупорки. V фасовки = 100 мл дои.откл = ± 3%
Проверяется не менее 3 флаконов от данной серии внутриаптечной заготовки.
По приказу М3 РФ № 214 от 16.07.97, внутриаптечная заготовка (каждая серия) подлежит полному химическому контролю обязательно.
Доказательство Са 2+ и глюконат-иона
• метод комплексонометрии (масса глюконата кальция рассчитывается на весь приготовленный объем внутриаптечной заготовки);
• метод рефрактометрии (определяется процентное содержание)
• Оформление результатов анализа:
• заполнить «Журнал регистрации результатов органолептического, физического и химического контроля внутриаптечной заготовки, лекарственных форм, изготовленных по индивидуальным рецептам (требованиям лечебных учреждений), концентратов, полуфабрикатов, тритураций, спирта этилового и фасовки»;
• в книге учета лабораторных и фасовочных работ поставить номер анализа и подпись провизора-аналитика.
• Оформление к отпуску
«Внутреннее». Предупредительная надпись «Беречь от детей».
Раствор кальция глюконата 5% — 100 мл.
На этикетке указаны номер и местонахождение аптечного учреждения, а также серия, срок годности, дата, цена.
Источник
Химический контроль
129. Химический контроль заключается в оценке качества изготовления лекарственных препаратов по показателям:
качественный анализ: подлинность лекарственных средств;
количественный анализ: количественное определение лекарственных средств.
Для проведения химического контроля оборудуется специальное рабочее место, оснащенное необходимым оборудованием, приборами и реактивами, обеспеченное документами в области контроля качества и справочной литературой.
Результаты качественного анализа регистрируются в журнале регистрации результатов органолептического, физического и химического контроля лекарственных препаратов, изготовленных по рецептам, требованиям и в виде внутриаптечной заготовки, концентрированных растворов, тритураций, спирта этилового и фасовки лекарственных средств, а также в журнале регистрации результатов контроля лекарственных средств на подлинность.
130. Качественному анализу в обязательном порядке подвергаются:
а) очищенная вода и вода для инъекций ежедневно из каждого баллона, а при подаче воды по трубопроводу — на каждом рабочем месте на отсутствие хлоридов, сульфатов и солей кальция. Вода, предназначенная для изготовления стерильных растворов, должна быть также проверена на отсутствие восстанавливающих веществ, солей аммония и углерода диоксида;
б) все лекарственные средства и концентрированные растворы (в том числе настойки гомеопатические матричные, тритурации гомеопатические первого десятичного разведения, растворы гомеопатические первого десятичного разведения), поступающие из помещений для хранения в помещения для изготовления лекарственных препаратов;
в) лекарственные средства, поступившие в аптечную организацию, к индивидуальному предпринимателю в случае возникновения сомнения в их качестве;
г) концентрированные растворы, жидкие лекарственные средства в бюреточной установке и в штангласах с пипетками, находящиеся в помещении изготовления лекарственных препаратов, при их заполнении;
д) расфасованные лекарственные средства промышленного производства;
е) гомеопатические лекарственные препараты в виде внутриаптечной заготовки. Качество лекарственного препарата оценивают по вспомогательным веществам.
Вода очищенная и вода для инъекций должны ежеквартально подвергаться полному качественному и количественному анализу.
131. При проведении химического контроля очищенной воды и воды для инъекций в журнале регистрации результатов контроля воды очищенной, воды для инъекций в обязательном порядке указываются:
а) дата получения (отгонки) воды;
б) дата контроля воды;
в) номер проведенного химического анализа;
г) номер баллона или бюретки, из которых взята на анализ вода;
д) результаты контроля на отсутствие примесей;
е) показатели рН среды;
ж) заключение о результатах анализа воды (удовлетворяет/не удовлетворяет);
з) подпись лица, проводившего анализ.
Журнал регистрации результатов контроля воды очищенной, воды для инъекций должен быть пронумерован, прошнурован и скреплен подписью руководителя учреждения и печатью вышестоящей организации.
132. Качественному анализу должны подвергаться выборочно лекарственные препараты различных лекарственных форм, изготовленные фармацевтом (провизором) в течение рабочего дня, но не менее 10% от общего количества изготовленных каждым фармацевтом лекарственных препаратов, кроме гомеопатических.
Гомеопатические лекарственные препараты в виде внутриаптечной заготовки изготавливают под наблюдением провизора-аналитика или провизора-технолога. В тритурациях гомеопатических и гомеопатических гранулах качество лекарственного препарата дополнительно оценивают по вспомогательным веществам.
133. При проведении химического контроля подлинности лекарственных средств в бюреточной установке, штангласах и штангласах с пипетками в журнале регистрации результатов контроля лекарственных средств на подлинность в обязательном порядке указываются следующие сведения:
а) дата заполнения бюреточной установки, штангласа;
б) порядковый номер химического анализа;
в) наименование лекарственного средства;
г) номер серии или номер анализа лекарственного средства производителя лекарственных средств;
д) номер заполняемого штангласа;
е) определяемое вещество (ион);
ж) результаты контроля по шкале «плюс» или «минус»;
з) подписи лиц, заполнивших и проверивших заполнение.
Журнал результатов контроля лекарственных средств на подлинность должен быть пронумерован, прошнурован и скреплен подписью руководителя аптечной организации (индивидуального предпринимателя) и печатью (при наличии печати).
134. Качественному и количественному анализу (полный химический контроль) подвергаются в обязательном порядке:
а) все растворы для инъекций и инфузий до стерилизации, включая определение значения рН, изотонирующих и стабилизирующих веществ. Растворы для инъекций и инфузий после стерилизации проверяются по значению рН, подлинности и количественному содержанию действующих веществ; стабилизаторы после стерилизации проверяются лишь в случае, предусмотренном документом в области контроля качества;
б) стерильные растворы для наружного применения (офтальмологические растворы для орошений, растворы для лечения ожоговых поверхностей и открытых ран, для интравагинального введения и иные стерильные растворы);
в) глазные капли и мази, содержащие наркотические средства, психотропные, сильнодействующие вещества. При анализе глазных капель содержание в них изотонирующих и стабилизирующих веществ определяется до стерилизации;
г) все лекарственные формы, предназначенные для лечения новорожденных детей и детей до 1 года;
д) растворы атропина сульфата и кислоты хлористоводородной (для внутреннего применения), растворы серебра нитрата;
е) все концентрированные растворы, тритурации, кроме гомеопатических тритураций;
ж) лекарственные препараты в виде внутриаптечной заготовки каждой серии, кроме гомеопатических лекарственных препаратов;
з) стабилизаторы, применяемые при изготовлении растворов для инъекций и инфузий, буферные растворы, применяемые при изготовлении глазных капель;
и) концентрация спирта этилового при разведении, а также в случае возникновения сомнений в качестве спирта этилового при его поступлении в аптечную организацию, к индивидуальному предпринимателю;
к) инъекционные гомеопатические растворы;
л) лекарственные формы, изготовленные по рецептам и требованиям, в количестве не менее трех лекарственных форм при работе в одну смену с учетом различных видов лекарственных форм. Особое внимание должно обращаться на лекарственные формы для детей, применяемые в офтальмологической практике, содержащие наркотические и ядовитые средства, растворы для лечебных клизм.
Источник